Внешний и внутренний пути свёртывания крови
Во внешнем пути свертывания крови участвуют тромбопластин (тканевой фактор, фактор III), проконвертин (фактор VII), фактор Стюарта (фактор X), проакцелерин (фактор V), а также Са2+ и фосфолипиды мембранных поверхностей, на которых образуется тромб. Гомогенаты многих тканей ускоряют свёртывание крови: это действие называют тромбопластиновой активностью. Вероятно, она связана с наличием в тканях какого-то специального белка. Факторы VII и X - проферменты. Они активируются путём частичного протеолиза, превращаясь в протеолитические ферменты - факторы VIIа и Xа соответственно. Фактор V – это белок, который при действии тромбина превращается в фактор V', который не является ферментом, но активирует фермент Xа по аллостерическому механизму; активация усиливается в присутствии фосфолипидов и Са2+.
В плазме крови постоянно содержатся следовые количества фактора VIIа. При повреждении тканей и стенок сосуда освобождается фактор III – мощный активатор фактора VIIа; активность последнего увеличивается более чем в 15000 раз. Фактор VIIа отщепляет часть пептидной цепи фактора X, превращая его в фермент - фактор Xа. Сходным образом Xа активирует протромбин; образовавшийся тромбин катализирует превращение фибриногена в фибрин, а также превращение предшественника трансглутаминазы в активный фермент (фактор XIIIа). Этот каскад реакций имеет положительные обратные связи, усиливающие конечный результат. Фактор Xа и тромбин катализируют превращение неактивного фактора VII в фермент VIIа; тромбин превращает фактор V в фактор V', который вместе с фосфолипидами и Са2+ в 104–105 раз повышает активность фактора Xа. Благодаря положительным обратным связям скорость образования самого тромбина и, следовательно, превращения фибриногена в фибрин нарастают лавинообразно, и в течение 10-12 с кровь свёртывается.
Свёртывание крови по внутреннему механизму происходит значительно медленнее и требует 10-15 мин. Этот механизм называют внутренним, потому что для него не требуется тромбопластин (тканевой фактор) и все необходимые факторы содержатся в крови. Внутренний механизм свёртывания также представляет собой каскад последовательных активаций проферментов. Начиная со стадии превращения фактора X в Xа, внешний и внутренний пути одинаковы. Как и внешний путь, внутренний путь свёртывания имеет положительные обратные связи: тромбин катализирует превращение предшественников V и VIII в активаторы V' и VIII', которые в конечном итоге увеличивают скорость образования самого тромбина.
Внешний и внутренний механизмы свёртывания крови взаимодействуют между собой. Фактор VII, специфичный для внешнего пути свёртывания, может быть активирован фактором XIIа, который участвует во внутреннем пути свёртывания. Это превращает оба пути в единую систему свёртывания крови.
Гемофилии.Наследственные дефекты белков, участвующих в свёртывании крови, проявляются повышением кровоточивости. Наиболее часто встречается болезнь, вызванная отсутствием фактора VIII – гемофилия А. Ген фактора VIII локализован в X- хромосоме; повреждение этого гена проявляется как рецессивный признак, поэтому у женщин гемофилии А не бывает. У мужчин, имеющих одну X-хромосому, наследование дефектного гена приводит к гемофилии. Признаки болезни обычно обнаруживаются в раннем детстве: при малейшем порезе, а то и спонтанно возникают кровотечения; характерны внутрисуставные кровоизлияния. Частая потеря крови приводит к развитию железодефицитной анемии. Для остановки кровотечения при гемофилии вводят свежую донорскую кровь, содержащую фактор VIII, или препараты фактора VIII.
Гемофилия В. Гемофилия В обусловлена мутациями гена фактора IX, который, как и ген фактора VIII, локализован в половой хромосоме; мутации рецессивны, следовательно, гемофилия В бывает только у мужчин. Гемофилия В встречается примерно в 5 раз реже, чем гемофилия А. Лечат гемофилию В введением препаратов фактора IX.
При повышенной свертываемости крови могут образоваться внутрисосудистые тромбы, закупоривающие неповрежденные сосуды (тромботические состояния, тромбофилии).
Фибринолиз. Тромб в течение нескольких дней после образования рассасывается. Главная роль в его растворении принадлежит протеолитическому ферменту плазмину. Плазмин гидролизирует в фибрине пептидные связи, образованные остатками аргинина и триптофана, причём образуются растворимые пептиды. В циркулирующей крови находится предшественник плазмина – плазминоген. Он активируется ферментом урокиназой, который содержится во многих тканях. Пламиноген может активироваться калликреином, также имеющимся в тромбе. Плазмин может активироваться и в циркулирующей крови без повреждения сосудов. Там плазмин быстро инактивируется белковым ингибитором α2- антиплазмином, в то время как внутри тромба он защищён от действия ингибитора. Урокиназа – эффективное средство для растворения тромбов или предупреждения их образования при тромбофлебитах, тромбоэмболии легочных сосудов, инфаркте миокарда, хирургических вмешательствах.
Противосвёртывающая система. При развитии системы свёртывания крови в ходе эволюции решались две противоположные задачи: предотвращать вытекание крови при повреждении сосудов и сохранять кровь в жидком состоянии в неповреждённых сосудах. Вторая задача решается противосвёртывающей системой, которая представлена набором белков плазмы, ингибирующих протеолитические ферменты.
Белок плазмы антитромбин III ингибирует все протеиназы, участвующие в свёртывании крови, кроме фактора VIIа. Он не действует на факторы, находящиеся в составе комплексов с фосфолипидами, а только на те, которые находятся в плазме в растворённом состоянии. Следовательно, он нужен не для регуляции образования тромба, а для устранения ферментов, попадающих в кровоток из места образования тромба, тем самым он предотвращает распространение свёртывания крови на поврежденные участки кровеносного русла.
В качестве препарата, предотвращающего свёртывание крови, применяется гепарин. Гепарин усиливает ингибирующее действие антитромбина III: присоединение гепарина индуцирует конформационные изменения, которые повышают сродство ингибитора к тромбину и другим факторам. После соединения этого комплекса с тромбином гепарин освобождается и может присоединяться к другим молекулам антитромбина III. Таким образом, каждая молекула гепарина может активировать большое количество молекул антитромбина III; в этом отношении действие гепарина сходно с действием катализаторов. Гепарин применяют как антикоагулянт при лечении тромботических состояний. Известен генетический дефект, при котором концентрация антитромбина III в крови вдвое меньше, чем в норме; у таких людей часто наблюдаются тромбозы. Антитромбин III – главный компонент противосвёртывающей системы.
В плазме крови есть и другие белки – ингибиторы протеиназ, которые также могут уменьшать вероятность внутрисосудистого свёртывания крови. Таким белком является α2- макроглобулин, который ингибирует многие протеиназы, и не только те, которые участвуют в свёртывании крови. α2-Макроглобулин содержит участки пептидной цепи, которые являются субстратами многих протеиназ; протеиназы присоединяются к этим участкам, гидролизируют в них некоторые пептидные связи, в результате чего изменяется конформация α2-макроглобулина, и он захватывает фермент, подобно капкану. Фермент при этом не повреждается: в комплексе с ингибитором он способен гидролизировать низкомолекулярные пептиды, но для крупных молекул активный центр фермента не доступен. Комплекс α2-макроглобулина с ферментом быстро удаляется из крови: время его полужизни в крови около 10 мин. При массивном поступлении в кровоток активированных факторов свёртывания крови мощность противосвёртывающей системы может оказаться недостаточной, и появляется опасность тромбозов.
Витамин К. В пептидных цепях факторов II, VII, IX, и X содержится необычная аминокислота - γ-карбоксиглутаминовая. Эта аминокислота образуется из глутаминовой кислоты в результате посттрансляционной модификации указанных белков:
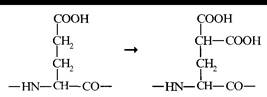
Реакции, в которых участвуют факторы II, VII, IX, и X, активируются ионами Са2+ и фосфолипидами: радикалы γ-карбоксиглутаминовой кислоты образуют центры связывания Са2+ на этих белках. Перечисленные факторы, а также факторы V' и VIII' прикрепляютя к бислойным фосфолипидным мембранам и друг к другу при участии ионов Са2+, и в таких комплексах происходит активация факторов II, VII, IX, и X. Ион Са2+ активирует также и некоторые другие реакции свёртывания: декальцинированная кровь не свёртывается.
Превращение глутамильного остатка в остаток γ-карбоксиглутаминовой кислоты катализируется ферментом, коферментом которого служит витамин К. Недостаточность витамина К проявляется повышенной кровоточивостью, подкожными и внутренними кровоизлияниями. В отсутствие витамина К образуются факторы II, VII, IX, и X, не содержащие γ-карбоксиглутаминовых остатков. Такие проферменты не могут превращаться в активные ферменты.
