Влияние внешних условий на спермиев вне организма животного 1 страница
Влияние температуры. И. И. Иванов (1908) доказал, что спермии лучше сохраняются при температуре от 0 до 15 °С. Более низкая и особенно высокая температура очень пагубны для них. Температура среды влияет на спермиев двояко: усиливает или ослабляет их движение, удлиняет или укорачивает пережи- ваемость.
Движение и переживаемость спермиев—два взаимосвязанных явления. Если спермиев поместить в среду с температурой 5 °С, они делаются малоподвижными или не двигаются. При подогревании спермы до 10 °С их движения становятся интенсивнее, и дальше, по мере повышения температуры, активность еще более возрастает и достигает максимума при температуре 38—41 °С. Таким образом, интенсивность движения спермиев прямо пропорциональна температуре среды, в которой они находятся.
С повышением температуры среды срок жизни спермиев укорачивается. В. Д. Клемина установила, что при температуре 46,5 "С белки спермиев переходят в состояние, близкое к необратимой денатурации.
Низкие температуры менее вредны для спермиев. При постепенном охлаждении можно довести сперму до состояния замораживания, а затем, после подогревания, восстановить ее активность и даже способность к оплодотворению. Быстрое охлаждение спермы, скачкообразные переходы от высоких температур к низким вызываюту спермиев температурный шок — реакцию спермиев на быстрое охлаждение. Она выражается потерей способности спермиев оживать при подогревании и разбавлении спермы специальными разбавителями, появлением уродливых форм спермиев. Если сперму быстро охладить хотя бы только до 15—17 "С, у спермиев может произойти температурный шок. Согласно исследованиям Ф. И. Осташко, шоковые явления у спермиев могут наступать при температуре 25 °С. Предложено много теорий и различных гипотез, но ни одна из них полностью не объясняет причин и механизмов возникновения температурного шока. Ф. И. Осташко считает, что в механизме шока важную роль играют осмотические и диффузионные процессы. Чем медленнее протекают эти процессы, тем меньше проявляется температурный шок. Вот почему медленное охлаждение — основной способ предупреждения температурного шока спермиев.
Особенно легко возникает температурный шок при охлаждении только что полученной спермы ниже 18 °С, поэтому в помещениях для получения и исследования спермы температура не должна быть ниже 18 °С. В сперме, имеющей нейтральную или щелочную реакцию, спермии сильнее реагируют на температуру, чем в сперме слабокислой реакции.
Низкие температуры отрицательно влияют на живые существа потому, что при замерзании разрушается цитоплазма их клеток (во время кристаллизации). Для объяснения отсутствия отрицательного влияния низких температур на спермиев предложена гипотеза о стекловидной форме замерзания цитоплазмы (витрификация). Согласно этой гипотезе, цитоплазма при охлаждении может затвердевать стекловидно (без кристаллов). При стекловидной форме в отличие от кристаллизации цитоплазма затвердевает без выделения воды, без резкого смещения молекул, вследствие чего не нарушается ее обычная структура.
При постепенном охлаждении спермы до минус 6—10 °С в ней интенсивно происходит кристаллизация, что вызывает быструю гибель спермиев. Для перевода жидкостей в стекловидное затвердевание необходимо при. приближении к 0 °С быстро их охладить, чтобы «проскочить» критическую фазу. Для «расстекловывания» цитоплазмы сперму нужно быстро нагревать, чтобы произошло расплавление тоже без фазы кристаллизации.
Возможность температурного шока следует учитывать, особенно при работе со спермой быка и барана, у которых вследствие малого объема эякулята сперма охлаждается очень быстро. Температурный шок легко наступает при проведении искусственного осеменения в холодную погоду, при использовании холодных инструментов, при несоблюдении правил хранения и перевозки спермы.
Реакцию спермиев на температуру следует расценивать как их приспособление в процессе эволюции. Известно, что в придатке тестикула спермии находятся в состоянии естественного анабиоза при температуре более низкой, чем температура тела; вследствие этого они могут долго сохранять свою жизнеспособность. Только после смешения спермиев с секретом придаточных половых желез они получают способность к активному движению. Попав же в половой аппарат самки, спермии (в условиях температуры тела) начинают двигаться с максимальной интенсивностью. Это обусловливает наиболее быстрое их продвижение по половым путям к яй- цепроводам и встречу с яйцевой клеткой.
Влияние света. Рассеянный дневной свет не воздействует вредно на спермиев. Под влиянием же прямых солнечных лучей движение спермиев вначале усиливается, а затем, через 20—40 мин, они погибают. Отрицательное действие солнечных лучей объясняют действием на спермиев ультрафиолетовой части спектра, активизирующей химические процессы, и термическим влиянием инфракрасных лучей. Поэтому при проведении искусственного осеменения нужно оберегать сперму от ультрафиолетовых лучей солнца и бактерицидных ламп.
Вся работа со спермой должна проводиться в закрытых помещениях. Поскольку рассеянный свет не влияет на спермиев, то для сохранения спермы можно пользоваться обычной стеклянной посудой, а еще лучше из оранжевого стекла, которое задерживает ультрафиолетовые лучи. В лаборатории пунктов искусственного осеменения на окнах следует повесить капроновые или полиэтиленовые занавески.
Влияние осмотического давления. Спермии, находясь в сперме, легко поддаются воздействию ее сыворотки. В свою очередь, они сами могут изменять химический состав спермы посредством пополнения ее продуктами своей жизнедеятельности. По этой причине величина осмотического давления спермы непостоянная. У быка, например, она колеблется при 0 "С от 481,2—914,2 кПа (4,812 до 9,142 ат), в среднем равна 695 кПа (6,95 ат). В связи с этим важно учитывать как физические, так и химические свойства жидкой части спермы.
Спермии очень чувствительны к изменению осмотического давления, т. е. концентрации веществ в жидкости, в которой они находятся. Ее осмотическое давление должно быть равным внутреннему осмотическому давлению спермиев. Если спермии поместить в гипотонический раствор или в обыкновенную воду, они быстро погибают вследствие повышения внутреннего давления. Под влиянием гипотонического раствора хвосты спермиев набухают и закручиваются кольцом или полукольцом. Если сперму смешать с гипертоническим раствором, спермии тоже погибнут, но уже от обезвоживания. Они сморщиваются, их хвосты приобретают зигзаговидную форму. Исключительно губительным для спермиев является быстрое изменение осмотического давления. При прочих благоприятных условиях спермии могут сохранять свою жизнеспособность только в изотонических растворах.
У спермиев животных разных видов осмотическое давление неодинаково. Так, раствор виноградного сахара будет изотоничен сперме барана в концентрации 6,4 %, быка и хряка — 6, жеребца — 7,2, кролика — 5,4, собаки — 5,7 %. Раствор тростникового сахара (сахароза) изотоничен сперме жеребца при 11%-ной концентрации. Спермии меньше реагируют на отклонение осмотического давления в сторону гипертонии, чем в сторону гипотонии.
При искусственном осеменении животных необходимо строго следить за тем, чтобы все растворы, применяемые для разбавления спермы, были изото- ничными и чтобы сперма не соприкасалась с водой. Обычная питьевая вода может содержать (в зависимости от условий местности) значительное количество различных солей, поэтому раствор, приготовленный без учета солевого состава воды, может оказать вредное влияние на спермиев.
Надо оберегать сперму от испарения ее жидкой части, например от подсыхания в спермоприемнике, при исследовании под микроскопом и при других манипуляциях, при которых может повыситься концентрация солей в сперме. Надо оберегать сперму и от недостатка солей; например, несколько капель дистиллированной воды, образовавшейся на стенках спермоприемника вследствие разности температур (конденсация), могут пагубно повлиять на эякулят барана или быка. Очень важна степень разбавления спермы. Чем она выше, тем чувствительнее спермии к отклонению от изотонии.
Влияние реакции среды. При работе со спермой нужно учитывать реакцию среды, т. е. концентрацию водородных ионов, которая влияет на обмен веществ, активность и переживаемость спермиев. Наиболее благоприятной для спермиев считается среда, рН которой колеблется для быка в пределах 6,9—7,0, для барана — 7,0—7,2, для хряка — 7,2— 7,5, для петуха — 7,2 и для кролика — 6,8. В кислой (рН 6,0 и ниже) и в сильнощелочной средах спермии погибают.
Переживаемость спермиев вне организма зависит от свойств кислоты. Под воздействием органических кислот (молочной, уксусной, янтарной, масляной и др.) движения спермиев прекращаются при небольшой кислотности среды. Неорганические кислоты (НС1, Н2804, Н3Р04 и др.), наоборот, даже в значительных концентрациях не влияют отрицательно на спермиев. Разница воздействия на спермиев органических и неорганических кислот объясняется неспособностью свободных ионов проникать в клетку, а следовательно, невозможностью влияния Н-ионов внешней среды на внутриклеточные реакции. Минеральные кислоты полностью диссоциированы в растворах, поэтому и не могут влиять на реакции, протекающие в спермиях. Растворы органических кислот всегда содержат молекулы, не распавшиеся на ионы, поэтому их молекулы проникают через оболочку спермиев, разлагаются в них на ионы, обусловливая внутриклеточное подкисле- ние. Надо учитывать и буферные свойства спермы. Вне организма буферность спермы — основной регулятор ее кислотности. У животных разных видов она неодинаковая. Высшей буферностью обладает сперма барана, затем быка и хряка, низшей — сперма жеребца.
Влияние химических веществ. В практике искусственного осеменения, несмотря на соблюдение всех правил асептики, полученная сперма всегда более или менее загрязнена бактериальной флорой. Стремление специалистов найти такое дезинфицирующее средство, которое могло бы действовать бактерицидно на микрофлору, не влияя отрицательно на спермиев, не увенчалось успехом. Исследования показали, что ни одно из современных дезинфицирующих веществ не может считаться безвредным для спермиев. В ничтожных дозах, неуловимых даже тончайшими химическими реакциями, они вредно влияют на спермиев. Этим следует объяснить неудачи искусственного осеменения животных, когда его проводят в ветеринарных лечебницах, амбулаториях или когда используют те же инструменты, которые применяются во время лечебной работы.
Установлено, что спермиев быстро убивают ртути дихлорид (сулема) в дозе 0,000003 г, перманганат калия в дозе 0,00004 г, лизол, креолин, уксусная кислота в дозе 0,0003 г на 1 г спермы. Щелочи и кислоты, эфир, нашатырный спирт, скипидар — сильные яды для спермиев. Оксиды свинца, меди, железа, серебра также очень ядовиты для спермиев. Поэтому в практике искусственного осеменения пользуются стеклянными или никелированными инструментами.
Токсичными для спермиев могут быть также резиновые камеры, дистиллированная вода, полиэтиленовые приборы и др. При обработке резиновых камер различными моющими средствами и кипячении в дистиллированной воде в течение часа токсичность резины не исчезает. Это указывает на необходимость обязательной биологической оценки каждого прибора и препарата, выпускаемых для целей искусственного осеменения животных.
Несмотря на то что в принципе при искусственном осеменении противопоказано применение дезинфицирующих средств, все же для обеззараживания инструментов вынужденно пользуются ими. Наиболее приемлем для этого этиловый спирт (этанол). По сравнению с другими дезинфицирующими средствами он легче удаляется с инструментов (быстро испаряется), кроме того, он хорошо растворяется в воде. Однако надо иметь в виду, что 0,5%-ный раствор спирта очень быстро убивает спермиев. Спирт-сырец денатурированный, недостаточно очищенный от сивушного масла и других примесей, совершенно непригоден в работе по искусственному осеменению животных.
Влияние микробной и грибковой загрязненности. Имеется прямая связь между степенью микробной, грибковой загрязненности, качеством спермы и опло- дотворяемостью животных. В естественных условиях у здоровых производителей в извитых канальцах семенника, придатках, спермиопроводах и начальной части уретры микроорганизмы отсутствуют. Таким образом, сперма инфицируется при ее прохождении через мочеполовой канал и соприкосновении с внешней средой. Количественный и качественный состав микроорганизмов в сперме сильно колеблется в зависимости от здоровья, гигиенического состояния производителя, стерильности искусственной вагины, манежа, лаборатории, срока хранения спермы и многих других факторов. Особенно много микроорганизмов отмечается в воздухе помещения, где содержатся производители. При плохих гигиенических условиях в 1 см3 воздуха находится до 1,6 млн микроорганизмов. У быков, выращенных в плохих гигиенических условиях, в 1 мл спермы содержится от 85 до 230 млн микроорганизмов (П. Маринов). У хряков одним из источников сильного загрязнения спермы микроорганизмами является дивертикул препуция (слепой мешок). После дивертикулоэктомии микробное загрязнение спермы резко снижалось, повышалась оплодотворяемость и плодовитость свиноматок (И. Г. Мороз, М. П. Рязанский).
Загрязнение спермы патогенными микроорганизмами может обусловить распространение при искусственном осеменении трихомоноза, вибриоза, бруцеллеза, туберкулеза, паратуберку- леза, лептоспироза, ящура и других инфекционных и инвазионных болезней. Сперма — хорошая питательная среда для сохранения и размножения многих патогенных и непатогенных микроорганизмов. При этом ни антибиотики, ни низкая температура при длительном хранении спермы не уменьшают количество микробных тел и не обеспечивают ее обеззараживания, так как видовой состав микробов необычайно разнообразен. В видовом отношении микрофлору в сперме подразделяют на четыре группы: сапрофитная, патогенная, условно-патогенная, протозои и риккет- сии.
Из условно-патогенной микрофлоры в сперме быков-производителей обнаруживают синегнойную и кишечную палочки, стафилококки, стрептококки, протеи и др. Наиболее патогенной является синегнойная палочка.
Г. В. Зверева и А. Н. Репко установили, что в свежей и разбавленной сперме наряду с бактериями встречаются гри-
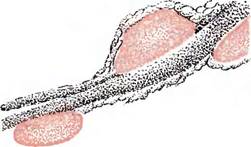 Рис. 19. Микробы на хвосте спермия (увеличение 3800 х 3)(Г. В. Зверева и Л. А. Черномаз) Рис. 19. Микробы на хвосте спермия (увеличение 3800 х 3)(Г. В. Зверева и Л. А. Черномаз) |
бы, обладающие патогенными и токсическими свойствами. Они выделили грибы 21 вида. Такие патогенные грибы, как СапсМа а1Ысапк, Акрег^Шик ГитщаШз, ЫсЫЬе1ггпа агутЫГега, обусловливают возникновение эндометритов у коров, а при наступлении беременности вызывают гибель эмбрионов и плодов.
Микробы, попавшие в сперму, располагаются в основном около спермиев, а часть из них в 1 —3 ряда — непосредственно на сперм иях — на головке, шейке, теле и хвосте (рис. 19). При воздействии микробов происходит набухание, а затем разрушение, распад перфо- ратория (колпачка) головки и всей оболочки спермия.
Для осеменения допускают сперму с содержанием в 1 мл не более 5 тыс. микробных тел при отсутствии патогенной микрофлоры и синегнойной палочки. Свежая неразбавленная сперма производителя должна иметь колититр (наименьшее количество исследуемого материала, в котором содержится одна кишечная палочка) не более 1:10.
МЕТОДЫ ПОЛУЧЕНИЯ СПЕРМЫ
При выборе метода получения спермы следует ориентироваться на такой, который отвечает следующим основным требованиям: позволяет получать весь эякулят без всяких потерь; не снижает количества и жизнеспособности спермиев; гарантирует здоровье производителей от травм и особенно от инфекционных болезней; прост технически, выполним в производственных условиях без сложного оборудования; обеспечивает стерильность получения спермы.
Все существующие методы получения спермы можно разделить на уретральные, позволяющие получать сперму непосредственно из уретры самца, и влагалищные, заключающиеся в собирании спермы из влагалища самки после ее естественного осеменения.
Уретральные методы получения спермы. Русский метод получения спермы разработали в 1931 г. Н. В. Комиссаров, В. И. Липатов,
И. И. Родин. Сущность его заключается в применении искусственной вагины, позволяющей воспроизводить механические и термические раздражения нервных окончаний полового члена производителя и получать от него полноценный эякулят.
Искусственная вагина — это прибор, состоящий из цилиндра, изготовленного из металла, резины или эбонита, в просвет которого вставлена эластичная резиновая трубка. Концы резиновой трубки завернуты на концы цилиндра, благодаря чему между внутренней поверхностью цилиндра и наружной поверхностью резиновой трубки образуется замкнутое пространство," сообщающееся с внешней средой через патрубок, предназначенный для вливания воды и нагнетания воздуха между стенками цилиндра и резиновой трубки. Один конец искусственной вагины остается открытым, а на другом укрепляют спермопри- емник для собирания спермы. Конст
рукция искусственных вагин имеет вариации в зависимости от вида животных.
Искусственная вагина для жеребца состоит из алюминиевого цилиндра, суживающегося впереди и оканчивающегося горловиной, на которую заворачивают передний конец резиновой камеры и надевают спермоприемник в виде широкого резинового стакана. В середине цилиндра имеется патрубок с завинчивающейся металлической пробкой (рис. 20). Путем отвинчивания и завинчивания пробки можно регулировать давление в полости искусственной вагины. Сбоку к цилиндру прикреплена ручка для удобства фиксации вагины. При получении спермы в холодном помещении на вагину надевают чехол.
Искусственная вагина для быка образца 1942 г. имеет цилиндр из толстой резины и эластичную камеру, концы которой завернуты на концы цилиндра. Концы резиновой камеры на цилиндре закрепляются резиновыми кольцами.
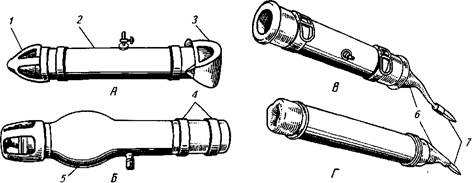 Рис. 21. Искусственные вагины для быка конструкции: А— образца 1942 г.; Б —И. И. Родина; В —датская; Г—английская; 1—спермоприемник; 2—цилиндр; 3— камера; 4—резиновые кольца; 5 —баллонообразное расширение; б—резиновая трубка; 7— стеклянный спермоприемник Рис. 21. Искусственные вагины для быка конструкции: А— образца 1942 г.; Б —И. И. Родина; В —датская; Г—английская; 1—спермоприемник; 2—цилиндр; 3— камера; 4—резиновые кольца; 5 —баллонообразное расширение; б—резиновая трубка; 7— стеклянный спермоприемник |
Для наполнения вагины водой и воздухом на цилиндре имеется патрубок, в который вставлен эбонитовый краник. На одном из концов искусственной вагины фиксируется резиновым держателем стеклянный двустенный спермо-
12 3 4 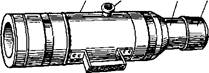 Рис. 20. Искусственная вагина для жеребца: 1 — цилиндр; 2 — патрубок с трубкой; 3 — горловина;4— спермоприемник Рис. 20. Искусственная вагина для жеребца: 1 — цилиндр; 2 — патрубок с трубкой; 3 — горловина;4— спермоприемник |
приемник. Исследования И. И. Родина показали, что при естественном осеменении во влагалище коровы кончик полового члена быка описывает почти полный круг диаметром 10—14 см. При получении спермы в искусственную вагину из-за узости ее цилиндра кончик пениса сгибается в сторону. По этой причине вследствие болезненности у производителя наступает торможение рефлекса эякуляции. Учитывая указанную особенность, И. И. Родин сконструировал более совершенную искусственную вагину с баллонообразным расширением для свободного движения конечной части полового члена. В этом случае эякуляция приближается к естественному акту без болевых ощущений и сжатия мочеполового канала.
В искусственных вагинах указанных образцов при опускании их спермопри- емником вниз после эякуляции микроорганизмы, осевшие на внутренней поверхности резиновой камеры, смешиваются со спермой и вместе с ней попадают в спермоприемник. Этот недостаток, снижающий санитарные качества спермы, устраняют укорочением искусственной вагины образца 1942 г. и присоединением к ней специальной конусообразной насадки из прозрачного термостойкого органического стекла с герметичным спермоприемником. Во время совокупительного толчка кончик полового члена быка выводится из искусственной вагины в просвет насадки и не соприкасается с ее стенками; здесь происходит выделение спермы непосредственно в спермоприемник, что обеспечивает ее стерильность,
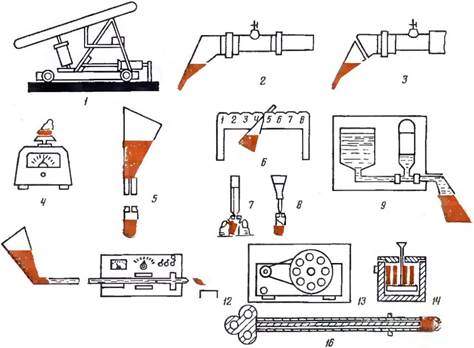
| Рис. 22. Схема Харьковской технологии асептического получения, разбавления, хранения и использования спермы быков: |
| 1 — механическое чучело; 2—искусственная вагина с полученным эякулятом; 3 — часть спермоприемника с эякулятом загерметизирована и отделена от искусственной вагины; 4 —определение массы спермы; 5 — отделение от спермоприемника чехла-пробирки с пробой спермы для оценки; 6— штатив для спермоприемников; 7— отбор пробы спермы в микропипетку из чехла-пробирки 8—взятие пробы спермы для микроскопирования 9—устройство для добавления разбавителей в спермоприемник: 10—переливание разбавленной спермы из спермоприемника в трубку для расфасовки; //—автомат ИУЖ для дозировки и герметизации доз спермы; 12—туба, служащая емкостью для накопления и хранения доз спермы; 13— устройство для эквилибрации и замораживания спермы; 14—замораживание спермы в ши- рокогорлом сосуде с жидким азотом; 15— шприц с дозой спермы; 16— инструмент для введения спермы в облицованных гранулах визоцервикальным способом или цервикальным с ректальной фиксацией шейки матки |
За рубежом применяют укороченные искусственные вагины (длина цилиндра 33 см) с уменьшенным диаметром. К одному из концов вагины присоединяют резиновую конусообразную трубку дли
ной 17 см со стеклянным спермоприем- ником в виде пробирки (рис. 21). Перед получением спермы на резиновую трубку со спермоприемником надевают специальный теплоудерживающий чехол. В момент глубокого совокупительного движения кончик пениса безболезненно загибается в резиновой трубке в сторону и происходит нормальная эякуляция. Широко используют укороченную искусственную вагину (цилиндр длиной 30 см) с разовым спермоприемником из полиэтиленовой пленки (рис. 22). Имеются и другие модели приборов, но все они построены по одному принципу.
Искусственная вагина для барана состоит из эбонитового цилиндра, она не содержит специальных колец для фиксации резиновой камеры, концы ее прочно удерживаются на цилиндре самостоятельно. Отверстие патрубка, находящегося на середине цилиндра, широкое, и в него вставляется резиновая пробка с эбонитовым краником.
Искусственная вагина для хряка. Для получения спермы от хряков пользуются укороченной искусственной вагиной, применяемой для быков, или одной из моделей А. В. Квасницкого. Укорочение искусственной вагины, предназначенной для быков, производят с учетом длины пениса хряка. При слишком короткой вагине наступает торможение половых рефлексов, а при длинной — потеря спермы (ее обратное вытекание). Поэтому необходимо производить индивидуальный подбор длины цилиндра. Спермоприемником служит темная широко- горлая стеклянная банка вместимостью 500 мл с пластмассовым фильтром, который можно заменить сложенной вдвое стерильной марлей. Спермоприемник присоединяют к вагине с помощью отрезка резиновой камеры, на котором сверху делают отверстие диаметром около 3 мм для выхода воздуха из спермоп- риемника в момент наполнения его спермой. На спермоприемник надевают ватный или поролоновый чехол. В последнее время стали использовать разовые спьрмоприемники из полиэтиленовой пленки. Их применение наряду с другими мероприятиями снижает микробную загрязненность спермы.
А. В. Квасницкий предложил электрическую и водоналивную искусственные вагины (рис. 23). Обе они имеют двустенные металлические цилиндры и собственно вагины. В электрической искусственной вагине вода быстро нагревается электросвечой, расположенной в нижней части между стенками цилиндра. Перед получением спермы свечу необходимо отключить от сети. Водоналивную искусственную вагину заправляют горячей водой. Собственно вагину (коническую металлическую трубку с патрубком и закрепленной резиновой камерой) вставляют в просвет нагретого металлического цилиндра, смазывают внутреннюю поверхность камеры стерильным вазелином и накачивают через патрубок воздух, давление которого контролируют с помощью водного манометра (нормальное давление 45—50 см вод. ст.). Спермоприемник (рис. 23, В) изготовлен из прозрачной пластмассы. Он состоит из градуированного цилиндрического стакана вместимостью 600 мл и навинчивающегося на него колпака. Для фильтрации спермы в процессе ее получения в спермоприемник вставляют специальный фильтр. Присоединяют спермоприемник к вагине при помощи резиновой соединительной трубки.
Главный недостаток всех искусственных вагин — непостоянство температуры в приборе. Для создания постоянной оптимальной температуры В. В. Петропавловский и Н. А. Чабовская сконструировали искусственную вагину с электрообогревателем в виде гибкой нихромовой электроспирали, вмонтированной в межстенное пространство. Постоянство температуры обеспечивается биметаллической пластинкой. Прибор питается от сети 220 В, нагревается через 6—8 мин после включения.
Для получения спермы от баранов И. И. Родин предложил специальный прибор — эякуля- тор, в котором использована закономерность термической реакции при плавлении и кристаллизации глауберовой соли и гипосульфита, что позволяет поддерживать постоянную температуру около 30 мин.
Искусственная вагина для кролика состоит из стеклянного баллона с двумя отверстиями, вокруг которых оттянуты выступы для укрепления внутренней резиновой трубки. Заполняют вагину теплой водой через отходящие от баллона два патрубка, соединенных с эбонито-
 Я В Рис. 24. Искусственные вагины(из К. Братанова): А — для петуха; Б — для селезня Я В Рис. 24. Искусственные вагины(из К. Братанова): А — для петуха; Б — для селезня |
выми кранами. В качестве спермопри- емника используют небольшую пробирку, которую присоединяют к стеклянному баллону рези новой муфтой. Искусственная вагина кролика отличается сравнительно большим объемом баллона для воды, чтобы быстро не охлаждался эякулят.
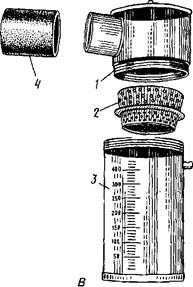 |
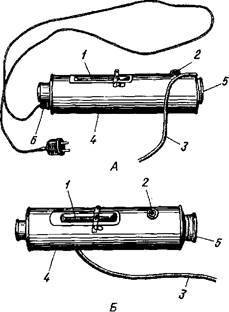 Рис. 23. Искусственные вагины для хряков: А — электрическая; Б — водоналивная: / — термометр; 2— отверстие для заливки воды; 3— трубка для накачивания воздуха; 4— кожух; 5— резиновая камера; 6 — электросвеча; В — спермоприемник к искусственной вагине: 1 — колпак; 2 — фильтр; 3 — стакан; 4 — резиновая трубка для соединения с искусственной вагиной Рис. 23. Искусственные вагины для хряков: А — электрическая; Б — водоналивная: / — термометр; 2— отверстие для заливки воды; 3— трубка для накачивания воздуха; 4— кожух; 5— резиновая камера; 6 — электросвеча; В — спермоприемник к искусственной вагине: 1 — колпак; 2 — фильтр; 3 — стакан; 4 — резиновая трубка для соединения с искусственной вагиной |
Искусственная вагина для птицы. Вагина для петуха состоит из основного цилиндра, сделанного из твердого каучука воронкообразной формы (рис. 24). Длина вагины 5 см, диаметр у входа 5 см, у выхода 1,5 см. Внутренняя трубка вагины сделана из эластичного каучука. В эту вагину получают сперму и от индюков. Искусственная вагина для селезня состоит только из основного цилиндра. Ее длина 10 см. Входная часть имеет воронкообразную форму, что облегчает введение полового члена. Ее диаметр 5 см, а на остальном протяжении вагины 1,5 см.
Получение спермы посредством искусственной вагины. У животных всех видов метод искусственной вагины позволяет получать сперму двумя путями: 1) на самку, самца или кастрата и 2) на манекен.
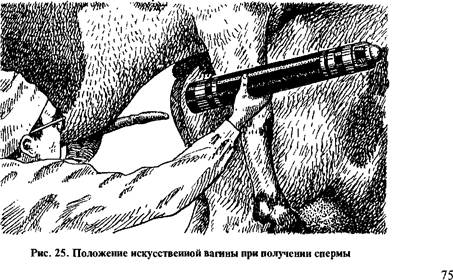
Сперму на животное получают в обстановке, обычно создаваемой при естественном осеменении. Его лучше помещать в станок. В момент садки техник держит подготовленную вагину справа на уровне таза животного. При получении спермы на искусственную вагину требуется определенный навык. Нельзя подставлять вагину к головке полового члена преждевременно или, наоборот, поздно, так как это обусловливает торможение эякуляции. Ее следует подставлять в тот момент, когда половой член производителя приближается к крупу манекена. При этом у быка, барана и хряка левой рукой препуциальный мешок вместе с половым членом смещают вправо так, чтобы его головка была направлена в отверстие искусственной вагины, которую удерживают другой рукой справа от таза животного-манекена на уровне тазобедренного сустава (рис. 25). При получении спермы от хряка искусственную вагину следует прижать во время эякуляции к боку таза свиноматки и слегка наклонить конец вагины со спермоприемником для того, чтобы эякулят быстрее стекал в последний.
 |
Делать это надо осторожно, чтобы не вызвать болевых ощущений. В половом члене быка много чувствительных нервных окончаний, и они сосредоточены главным образом в головке пениса. Одни из них, так называемые колбы Краузе, воспринимают температурные раздражения. При этом поверхностно лежащие колбы Краузе возбуждаются под влиянием холода, а глубоко лежащие — под воздействием тепла. Другие нервные окончания — Фатер-Пачиние- вы тельца — воспринимают давление; они находятся в висцеральном листке препуция. Имеются еще тельца Мейс- нера, являющиеся органами осязания, и нервные чувствительные окончания, воспринимающие боль. Чрезмерное возбуждение этих нервных окончаний тормозит проявление совокупительного рефлекса и эякуляции. У хряка и жеребца в отличие от быка и барана эякуляция
происходит в результате соответствующих раздражений нервных окончаний не только головки, но и основания полового члена.
