Гемоглобиновая буферная система.
В физиологическом диапазоне рН оксигемоглобин – в 70 раз более сильная кислота, чем восстановленный гемоглобин. После высвобождения кислорода в тканях у гемоглобина возрастает способность связывать ионы водорода.
Гемоглобиновый буфер обеспечивает 35% буферной емкости крови.
Оксигемоглобин, образующийся в легких, ведет себя как кислота, поэтому смещения рН в кислую сторону не происходит. В капиллярах НbО2 теряет часть кислотных свойств. Образующийся редуцированный гемоглобин связывает ионы водорода и освобождает ионы калия, которые при ацидозе выходят из эритроцитов, вызывая гиперкалиемию. Ионы калия затем выводятся почками.
Под влиянием избытка СО2 сродство гемоглобина к кислороду падает, а диссоциация оксигемоглобина повышается (рис. 3).
На схеме представлены кривые диссоциации оксигемоглобина при различных значениях рСО2. Поскольку угол наклона кривой графика характеризует скорость реакции, то с уменьшением рСО2 увеличивается угол наклона кривой диссоциации по отношению к оси абсцисс. Влияние рН и рСО2 на сродство гемоглобина к кислороду называется эффектом Бора. Эффект Бора свидетельствует о тесной сопряженности процессов связывания и высвобождения кислорода и двуокиси углерода, обеспечивающей эффективность дыхания.
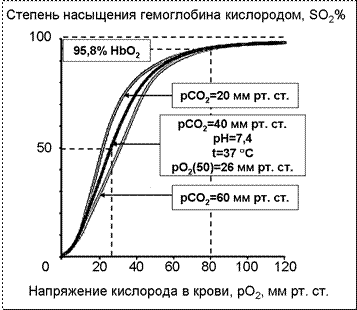
Рис. 3. Кривая диссоциации оксигемоглобина при различных значениях напряжения двуокиси углерода
Уменьшение емкости гемоглобинового буфера происходит при кровопотере, гемолизе, анемиях.
Концентрация водородных ионов почти полностью определяется соотношением бикарбоната и углекислоты. Содержание этих веществ в крови тесно связано с процессом переноса кровью углекислого газа (СО2) от тканей к легким. Физически растворенный СО2 диффундирует из тканей в эритроцит в соответствии с градиентом концентрации, поскольку в эритроцитах образуется мало углекислого газа. В эритроците под действием фермента карбоангидразы происходит гидратация молекулы СО2 с образованием угольной кислоты (Н2СО3), сразу же диссоциирующей на ион бикарбоната и ион водорода (рис. 4).
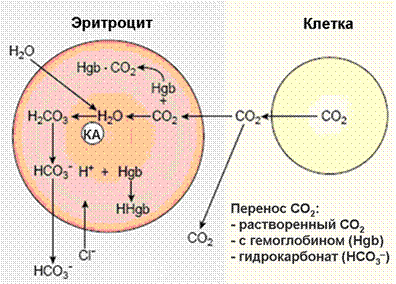
Рис. 4. Химические реакции, протекающие в эритроцитах при газообмене в тканях.
Накапливающиеся ионы НСО3ˉ диффундируют по градиенту концентрации в плазму. Электрохимическая нейтральность поддерживается за счет перемещения в эритроциты ионов хлора (хлоридный сдвиг).
В физиологических условиях повышение рСО2 в венозной крови стимулирует образование НСО3ˉ в эритроцитах. Наоборот, снижение рСО2 в артериальной крови угнетает образование бикарбоната. При этом обеспечивается постоянство артерио-венозной разницы НСО3ˉ/СО2 и, следовательно, рН.
При патологических процессах, сопровождающихся изменениями рСО2, эти механизмы сохраняются.
Буферные свойства крови обусловлены, в конечном итоге, суммарным эффектом всех анионных групп слабых кислот, важнейшими из которых являются бикарбонаты и анионные группы белков.
2.4.5. Калиево-водородный обмен.
Свободное перемещение одноименно заряженных ионов калия (К+) и водорода (Н+) между внутриклеточным и внеклеточным секторами организма имеет важное значение в регуляции кислотно-основного равновесия. В случаях внеклеточного ацидоза избыточные ионы водорода мигрируют внутрь клеток для буферирования. При этом ион К+ покидает клетку и выходит во внеклеточную жидкость. В случаях снижения уровня внеклеточного калия, ионы К+ перемещаются в клетки и заменяются ионами водорода. Таким образом, изменения уровней внеклеточного калия могут оказывать влияние на кислотно-основное состояние, а изменения кислотно-основного состояния влияют в свою очередь на концентрацию внеклеточного калия. Сдвиги калия более выражены при метаболическом ацидозе, чем при респираторном ацидозе. Следует отметить, что метаболический ацидоз, развивающийся в результате накопления неорганических кислот (например, фосфорной кислоты при почечной недостаточности), приводит к более значительному повышению калия во внеклеточном пространстве, чем ацидоз, вызываемый аккумуляцией органических кислот (например, лактата, кетокислот).
