Гидрокарбонатная буферная система.
БУФЕРНЫЕ СИСТЕМЫ ОРГАНИЗМА
Важнейшие буферные системы организма
Главным источником ионов водорода в организме является углекислый газ, который образуется в результате метаболизма (обмена веществ) в количестве 15 000 ммоль/сут.
Гидратация углекислого газа приводит к образованию угольной кислоты:
СО2 + Н2О ↔ Н2СО3 ↔ НСО3- + Н+.
В меньшей степени количество ионов Н+ (30 – 80 ммоль/сут) обусловлено поступлением в организм, а также образованием в нём таких кислот, как серная (в результате обмена серосодержащих аминокислот), фосфорная (при метаболизме фосфорсодержащих соединений), органические кислоты, образующиеся при неполном окислении липидов и углеводов.
Организм освобождается от кислот благодаря процессам дыхания и мочевыделения, т.е. в нём существует взаимосвязь между метаболическими процессами и газообменом. В оценке кислотно-основного состояния организма важно не только определение значения рН, но и характеристика механизмов, обеспечивающих регуляцию этого параметра.
Если бы в организме не было немедленных буферных механизмов и респираторной (дыхательной) компенсации, то тогда даже обычные, ежедневные нагрузки кислотами сопровождались бы значительными колебаниями величины рН.
Постоянство рН жидких сред организма поддерживается в живых организмах буферными системами.
Добавление сильной кислоты или сильной щелочи вызывает защитную реакцию буферной системы по сохранению постоянного значения рН среды, что объясняется связыванием добавляемых Н+ и ОН- и образованием малодиссоциирующих электролитов.
Рассмотрим кратко важнейшие буферные системы организма:
Гидрокарбонатная буферная система.
Гидрокарбонатная буферная система образована оксидом углеродом (IV), взаимодействие которого с водой приводит к образованию равовесной системы:
СО2 + Н2О ↔ СО2·Н2О ↔ Н2СО3 ↔ Н+ + НСО3¯
В этой системе донором протона является угольная кислота Н2СО3, а акцептором протона – гидрокарбонат-ион НСО3¯ .
Если в кровь поступает кислота и увеличивается концентрация иона водорода, то он взаимодействуя с НСО3-, смещает равновесие в сторону Н2СО3 и приводит к выделению газообразного СО2, который выводится из организма в процессе дыхания через лёгкие:
Н+ + НСО3¯ ↔ Н2СО3 ↔ СО2 ↑ + Н2О
При поступлении в кровь оснований, они связываются угольной кислотой, и равновесие смещается в сторону НСО3¯:
ОН- + Н2СО3 ↔ НСО3¯ + Н2О
Условно всё количество СО2, как физически растворённого, так и гидратированного - Н2СО3, принято рассматривать как угольную кислоту. Уравнение
рН = рКа + lg 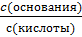
применительно к гидрокарбонатной буферной системе (уравнение Гендерсона-Гассельбаха) имеет следующий вид:
рН = 6,1 + lg 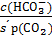 ; рН = 6,1 + lg
; рН = 6,1 + lg 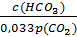
где s´ -коэффициент растворимости СО2 в воде при парциальном давлении 101 кПа.
Протекающая в организме обратимая реакция СО2 + Н2О ↔ Н+ + НСО3- ускоряется ферментом к а р б о а н г и д р а з ой.
Анализ соотношения концентраций кислотной и основной форм гидрокарбонатной буферной системы показывает, что буферная ёмкость по кислоте значительно больше буферной ёмкости по основанию. Главное назначение гидрокарбонатной системы заключается в нейтрализации кислот. Гидрокарбонатный буфер представляет собой основную буферную систему плазмы крови; он является системой быстрого реагирования, так как продут его взаимодействия с кислотами – СО2 – быстро выводится через лёгкие. Помимо плазмы, гидрокарбонатная система содержится в эритроцитах, интерстициальной жидкости, почечной ткани.
Однако при заболеваниях органов системы дыхания, кровообращения, печени, почек, при отравлениях, голодании, ожоговой болезни, неукротимой рвоте, изнуряющих поносах и так далее может иметь место нарушение кислотно-основного равновесия. Оно сопровождается либо увеличением концентрации ионов водорода в жидкостях организма (ацидоз) либо уменьшением концентрации ионов водорода (алкалоз).
Ацидоз встречается чаще, так как в организме при распаде многих веществ образуются кислоты. Буферные системы крови и почки стабилизируют рН крови и тем самым рН всей внутренней среды организма.
Ещё одной важной буферной системой является гидрофосфатная буфернаясистема, она присутствует как в крови, так и в клеточной жидкости других тканей, особенно почек. В клетках она представлена солями К2НРО4 и КН2РО4, а в плазме крови и межклеточной жидкости Na2НРО4 и NaН2РО4.
Дигидрофосфат-ионы являются кислотами, а гидрофосфаты – основаниями.
При увеличении концентрации катионов Н+ во внутриклеточной жидкости, например, в результате переработки мясной пищи, происходит их нейтрализация ионами НРО42-:
Н+ + НРО42- ↔ Н2РО4-
Образующийся избыточный дигидрофосфат выводится почками, что приводит к снижению величины рН мочи.
При увеличении концентрации оснований в организме, например, при употреблении растительной пищи, они нейтрализуются ионами Н2РО4-:
ОН- + Н2РО4- ↔ НРО42- + Н2О
Образующийся избыточный гидрофосфат выводится почками, при этом рН мочи повышается. Выведение тех или иных компонентов фосфатной буферной системы с мочой, в зависимости от перерабатываемой пищи, объясняет широкий интервал значений рН мочи – от4,8 до 7,5. В отличие от гидрокарбонатной, фосфатная система более «консервативна», так как избыточные продукты нейтрализации выводятся через почки и полное восстановление отношения [HPO42-] / [H2PO4-] происходит только через 2-3 суток. Деятельности лёгочной и почечной компенсации нарушений отношения компонентов в буферных системах необходимо учитывать при терапевтической коррекции нарушений кислотно-основного равновесия организма.
Белковые буферные системы
Белковые буферные системы являются амфолитными, так как они способны присоединять или отщеплять протоны вследствие присутствия в белках групп с кислотными свойствами (-СООН и -NH3+) и основными свойствами (-СОО- и -NH2). Механизм действия такой буферной системы можно представить следующим образом.
Кислотная буферная система:
а) H3N+ ─ R ─ COOH + OH- ↔ H2N ─ R ─ COOН + H2O
Белок – кислота
б) H3N+ ─ R ─ COO- + H+ ↔ H3N+ ─ R ─ COOH
Соль белка – Кислоты
(сопряженное основание)
Основная буферная система:
а) H2N ─ R ─ COO- + H+ ↔ H3N+ ─ R ─ COO-
Белок – основание
б) H3N+ ─ R ─ COO- + ОН- ↔ H2N ─ R ─ COO- + H2O
Соль белка – Основания
(сопряженная кислота)
где R – макромолекулярный остаток белка.
Роль белков плазмы крови в гомеостазе ионов водорода весьма мала.
Гемоглобиновая буферная система является сложной буферной системой эритроцитов, которая включает в качестве донора протона две слабые кислоты: гемоглобин ННb и оксигемоглобин ННbO2. Роль акцептора протона играют сопряженные этим кислотам основания, т.е. их анионы Hb1- и HbO21-. Механизм буферного действия этой системы основан на следующих реакциях:
H+ + Hb- ↔ HHb pKa(HHb) = 8,20
H+ + HbO21- ↔ ННbO2 ↔ HHb + O2 pKa(HHbO2) = 6,95
При добавлении кислот поглощать ионы Н+ в первую очередь будут анионы гемоглобина, которые имеют большое сродство к протону. При действии основания оксигемоглобин будет проявлять большую активность, чем гемоглобин:
ОН- + ННbO2 ↔ HbO2- + H2O ОН- + ННb ↔ Hb- + H2O
Таким образом, гемоглобиновая система крови играет значительную роль сразу в нескольких важнейших физиологических процессах организма: дыхании, транспорте кислорода в ткани и поддержании постоянства рН внутри эритроцитов, а в конечном итоге – в крови. Эта система эффективно функционирует только в сочетании с другими буферными системами крови.
