Порядок работы с микроскопом
Методические указания
1.1. Оборудование рабочего места.
На рабочем столе должно быть все необходимое для работы: микроскоп, иммерсионное масло, бактериологическая петля, спиртовка, набор красок, промывалка и ванна для промывки препаратов, предметные стекла и салфетки для протирания их, штатив для пробирок с культурами, пинцет, фильтровальная бумага для высушивания препаратов и банка для отработанных стекол.
Из личных вещей студента на рабочем месте допускается иметь только рабочую тетрадь, в которой делают записи и зарисовки. Ничего лишнего (в том числе учебников и других книг) на рабочем столе не должно быть.
1.2. Режим работы в бактериологической лаборатории.
Работа с болезнетворными микробами требует обязательного соблюдения ряда правил личной и общественной профилактики. Каждый студент обязан работать в халате, на голову надевать шапочку или косынку, не курить и не принимать пищу в лаборатории, избегать суеты. По окончании работы необходимо вымыть руки с мылом.
2. Важнейшей характеристикой каждого объектива микроскопа является его разрешающаяся способность. Разрешающей способностью называется расстояние между двумя точками, при котором они еще видны раздельно (т.е. не сливаются в одну). Разрешающая способность объектива ограничивается такими недостатками оптической системы, как сферическая и хроматическая аберрации ,дифракция и т.д. Если первые два явления устранимы, то явление дифракции имеет место в любой оптической системе. Оно ограничивает разрешающую способность оптических систем. Разрешающая способность объектива с учетом явлений дифракции описывается следующей формулой:
А = 0,61 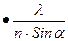 ,
,
где А - минимальное расстояние между двумя точками объекта (разрешающая способность);
n - показатель преломления среды между препаратом и фронтальной линзой объектива (в случае масляной иммерсии n=1,51);
α- угол между оптической осью объектива и наиболее крайним лучом, попадающим в объектив из центра препарата;
λ- длина световой волны;
0,61 - коэффициент, который учитывает геометрические факторы при вычислении освещенности первого дифракционного максимума от круглого отверстия.
Величина n·Sinα постоянна для каждого объектива и называется числовой, или нумерической, апертурой. Она выгравирована на оправе объектива. В монобромнафталиновых иммерсионных объективах нумерическая апертура может варьировать в пределах от 1,25 до 1,60. При наличии воздуха между фронтальной линзой и покровным стеклом нумерическая апертура не превышает 0,95.
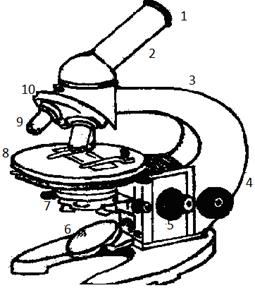 | Микроскоп. Обозначения: 1 - окуляр; 2 - тубус; 3 – штатив (колонка и ножка); 4-макрометрический винт; 5- микрометрический винт; 6- зеркало; 7 - конденсор; 8- предметный столик; 9- объектив; 10 – револьвер. |
Из приведенной выше формулы видно, что разрешающая способность объектива прямо пропорциональная его числовой апертуре и обратно пропорциональна длине волны света, используемого при микроскопии. При микроскопии в видимом свете с длиной волны порядка 0,55 микрона и иммерсионным объективом с максимальной нумерической апертурой 1,60 разрешающая способность равна:
А = 0,61 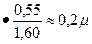
Величина угла, при котором глаз способен различать раздельно две точки, называется углом резкого зрения. Для получения на сетчатке раздельного изображения двух точек световые лучи должны попасть в глаз под углом зрения, который стягивает дугу от 2 до 4 минут.
Изображение структур, разрешенных объективом, может быть увеличено окуляром лишь настолько, чтобы оно просматривалось под углом, стягивающим дугу величиной от 2 до 4 минут. Это - полезное увеличение микроскопа. Полезное увеличение микроскопа не может превышать числовую апертуру более чем в 1000 раз. Поэтому максимальное полезное увеличение для микроскопов, имеющих иммерсионные объективы с апертурой 1,4-1,6, составляет 1400-1600. Применение в таких микроскопах более сильных окуляров никаких дополнительных деталей к структуре препарата, разрешаемой объективом, не выявляет.
Для полного использования разрешающей способности иммерсионного объектива необходимо выполнять следующие основные правила:
1)Конденсор осветительного аппарата должен быть поднят до отказа (до уровня предметного столика).
2)Диафрагма конденсора должна быть полностью открыта.
3)Во всех без исключения случаях работа ведется с плоским зеркалом, так как конденсор рассчитан на работу с параллельными пучками света.
Наряду с увеличением и нумерической апертурой одной из важных характеристик объектива является его свободное рабочее расстояние, т.е. расстояние между верхней поверхностью препарата и нижней поверхностью фронтальной линзы объектива при наведенном на фокус объективе. Эти расстояния следующие:
для объектива с увеличением 8× - 8,5 мм;
для объектива с увеличением 40× - 0,4 мм;
для объектива с увеличением 90× - 0,2 мм.
Знание этих расстояний необходимо для того, чтобы быстро сфокусировать микроскоп на препарате. Кроме того, чтобы правильно и быстро установить освещение, необходимо, чтобы объектив находился от препарата на свободном рабочем расстоянии.
Порядок работы с микроскопом
1.Проверить состояние осветительного аппарата (поднять конденсор, открыть его диафрагму, поставить плоское зеркало).
2.Положить на столик микроскопа исследуемый препарат (дрожжи, окрашенные фуксином) и поставить слабый сухой объектив (8×) на расстояние несколько меньше свободного рабочего расстояния (для данного объектива 5-7 мм).
3. Глядя в окуляр и вращая зеркалом, произвести предварительную установку освещения,
4. Медленно поднимая тубус макровинтом, добиться резкого изображения препарата. При использовании слабого сухого объектива в поле зрения, кроме препарата, может быть видно изображение источника света, т.е. оконной рамы и других предметов, находящихся за окном.
5.Движением зеркала поставить в центре поля зрения наиболее светлый участок оконной рамы (например, участок неба с облаками), после чего можно переходить на микроскопию с сильным сухим или иммерсионным объективами. При этом мешающие детали исчезают из поля зрения, Если этого не происходит, то следует осторожно приподнять или опустить конденсор на 1-1,5 мм.
6.Поставив сильный сухой или иммерсионный объектив, ни в коем случае нельзя опускать тубус микроскопа, глядя в окуляр. Необходимо под контролем глаза, глядя сбоку, опустить объектив на расстояние меньше свободного рабочего, а затем, глядя в окуляр, макровинтом медленно поднимать тубус до тех пор, пока появится мелькание препарата. После этого точная установка достигается с помощью микровинта. Не следует делать микровинтом более половины оборота в одну или другую сторону. При фокусировке микроскопа полезно левой рукой слегка двигать препарат по поверхности предметного столика.
3. Пользуясь изложенными сведениями, необходимо научиться быстро и правильно устанавливать препарат в фокусе при всех трех объективах. Рассматривая препарат, следует обратить внимание на резкое увеличение числа разрешаемых подробностей при работе с иммерсионным объективом по сравнению с сухими объективами.
 |  |  |
| объектив 8× | объектив 40× | объектив 90× |
| Дрожжевые клетки Saccharomyces cerevisiae |
4. Необходимо твердо усвоить основные приемы бактериологической техники: обращение с культурами микробов, использование бактериологической петли, спиртовок, способы обеззараживания использованного материала и отработанных стекол.
При работе с культурами микроорганизмов необходимо соблюдать следующие два основные принципа: 1 - не загрязнить микробами окружающей среды и не заразить самого себя и 2 - не загрязнить культуру посторонними микробами из окружающей среды, так как точная идентификация исследуемого возбудителя заболевания возможна лишь при условии выделения и сохранения его в чистой культуре.
Культуру бактерий сохраняют обычно на жидких и плотных питательных средах в пробирках, закрытых ватно-марлевыми пробками. При всех манипуляциях с культурой (приготовление мазка, пересев ее с одной среда на другую и т.д.) используют стерильную бактериологическую петлю из металлической проволоки. Правильно приготовленная петля диаметром от I до 5 мм должна быть полностью замкнута и не должна иметь лишнего свободного конца. Петлю стерилизуют прокаливанием докрасна в пламени горелки, держа ее сначала вертикально, затем проводят 3-4 раза через пламя прилегающую к петле часть петледержателя.
Для соблюдения вышеуказанных принципов в случае приготовления бактериологическую петлю берут в правую руку как ручку или карандаш, а пробирку держат в левой руке между большим и указательным пальцами с тыльной стороны кисти почти в горизонтальном положении. При этом должна быть хорошо видна поверхность питательной среды с культурой бактерий.
Простерилизовав петлю, правой рукой захватывают пробку, прижимая ее мизинцем к ладони, освобождают ее небольшим поворотом, вынимают над пламенем горелки и, не выпуская пробку из руки (в таком положении она сохраняется в течение последующих манипуляций) обжигают края пробирки. Петлю вводят в пробирку, остужают прикосновением к внутренней стороне стекла и берут ею небольшое количество культуры, стараясь не захватить при этом питательной среды. Вынув петлю, опять обжигают края пробирки, слегка обжигают пробку и закрывают ею пробирку. Не выпуская петли из руки, ставят пробирку в штатив и приступают к приготовлению мазка. После этого петлю стерилизуют и ставят в штатив.
С соблюдением этих основных правил производят и все другие манипуляции с культурами бактерий - пересев из пробирки в пробирку» из пробирки в чашку, из чашки в чашку и т.п.
В случае попадания культуры микробов на руки, другие предметы и пол необходимо немедленно протереть руки и загрязненные предметы ватой, смоченной дезинфицирующим растворов, а пол залить этим же раствором. Через 30 минут руки можно вымыть с мылом.
5. На чистое сухое предметное стекло нанести с помощью бактериологической петли каплю воды. Прокаленной и остуженной петлёй внести в небольшое количество (одну петлю) микробной массы и равномерно перемешать с водой. Петлю прокалить и поставить в штатив. Накрыть каплю чистым покровным стеклом и придавить его слегка рукояткой петли. Полученную "раздавленную каплю" поместить на предметный столик микроскопа и промикроскопировать сначала со слабым сухим объективом, затем с сильным сухим объективом и, наконец, с иммерсионным. Для установки препарата в фокусе следует найти вначале при малом увеличении капли, вывести его в центр поля зрения и затем по нему ориентироваться.
При микроскопии необходимо помнить, что рассматривание неокрашенного препарата возможно только с ограниченным освещением, что достигается опусканием конденсора или уменьшением отверстия ирис-диафрагмы,
6. На чистое предметное стекло наносят каплю воды и рядом с ней несколько больших размеров каплю туши. В каплю воды вносят небольшое количество исследуемой культуры (получается облачко помутнения). Прокалив и остудив петлю(чтобы сжечь оставшуюся массу бактерий), готовят равномерную взвесь бактерий. Затем соединяют эту каплю с каплей туши, тщательно перемешивают и размазывают по стеклу тонким слоем. Высушивают мазок на воздухе и микроскопируют с иммерсионным объективом.
При микроскопии препарата рекомендуется начинать с более светлых участков его, а затем переходить на более темные. Необходимо помнить, что при негативных способах окраски микробы остаются не убитыми.
 |  |
| Сарцина Sarcina , Негативная окраска по Бурри | Стрептобацилла Streptobacillus («раздавленная капля») |
7. Основные формы бактерий. Готовые окрашенные препараты-мазки из культур стафилококка, стрептококка, сарцины (кокковые формы); монобактерии, стрептобациллы (палочковидные формы); вибриона (извитая форма) промикроскопировать и зарисовать. Обратить внимание на форму и взаиморасположение бактерий в каждом препарате.
 |  |  |
| Стафилококк Staphylococcus | Стрептококк Streptococcus | Сарцина Sarcina |
 |  |  |
| Монобактерии Monobacterium | Стрептобацилла Streptobacillus | Вибрион Vibrio |
Контрольные вопросы
От чего зависит разрешающая способность микроскопа?
Почему иммерсионные объективы имеют более высокую разрешающую способность по сравнению с сухими объективами с тем же отверстным утлом?
Что такое нумерическая апертура и по какой формуле она определяется?
Чему равны разрешающая способность современных оптических микроскопов и их полезное увеличение?
На какой высоте должен находиться при микроскопии конденсор?
Каким зеркалом следует пользоваться при работе на микроскопах, снабженных конденсором?
Чему равны свободные рабочие расстояния объективов микроскопов и для чего необходимо их знать?
Каким винтом микроскопа следует производить наводку на резкость?
Как следует производить наводку" микроскопа на резкость, чтобы избежать повреждения объектива и препарата?
Как выявить наличие загрязнения в окуляре?
Как правильно приготовить бактериологическую петлю?
Как следует держать пробирку, петлю и пробку при взятии материала для приготовления препарата?
Как предохранить культуру микроорганизма от загрязнения из воздуха?
Как производится негативная окраска препарата по Бурри?
Как выглядят бактерии в препарате, приготовленном по Бурри?
Как должно быть установлено освещение при микроскопии неокрашенных препаратов ("раздавленная капля")?
Как устроен люминесцентный микроскоп?
Каким светом наиболее целесообразно вызывать люминесценцию препарата и почему?
Каково назначение желтого окулярного светофильтра в люминесцентном микроскопе?
Что такое флуорохромирование, какие флуорохромы чаще применяются?
В чем заключается принцип иммунофлуоресцентного метода исследования?
В чем сущность темнопольной микроскопии?
В чем сущность фазовоконтрастной микроскопии?
Из каких трех основных систем состоит электронный микроскоп просвечивающего типа?
Почему разрешающая способность электронного микроскопа во много раз выше разрешающей способности светооптических микроскопов?
Приложение к ЗАНЯТИЮ 1.
