Чувствительность микроорганизмов к антибиотикам - Н. А. Бельская
(Согласно Приказу Министерства здравоохранения СССР № 250 от 13.03.75 г. "Об унификации методов определения чувствительности микроорганизмов к химиотерапевтическим препаратам".)
В клинической практике чувствительными к антибиотикам считают те микроорганизмы, на которые антибиотики оказывают бактериостатическое или бактерицидное действие.
При любом лабораторном исследовании критерием чувствительности микроорганизмов к антибиотикам является минимальная концентрация антибиотика, ингибирующая (задерживающая) рост возбудителя заболевания при стандартных условиях постановки опыта.
Для определения лекарственной чувствительности оптимальным является использование чистой культуры возбудителя. Выделять культуры микробов из организма для исследования на чувствительность следует до начала лечения антибиотиками, так как под их воздействием рост возбудителя заболевания может быть полностью угнетен. Чувствительность микроорганизмов к антибиотикам определяют методом диффузии в агар с применением стандартных дисков или методом серийных разведений в жидких и плотных питательных средах.
Методы определения
Метод дисков. Взвесь изучаемой культуры засевают "газоном" (см. главу 7). В качестве посевного материала можно использовать суточную бульонную культуру или 1 миллиардную микробную взвесь, приготовленную по оптическому стандарту мутности № 10 (см. ниже). Засеянные чашки подсушивают 30-40 мин при комнатной температуре. Затем на поверхность засеянного агара пинцетом накладывают бумажные диски, пропитанные растворами различных антибиотиков. Каждый диск слегка прижимают браншами пинцета, чтобы он плотно прилегал к поверхности агара. Диски накладывают на равном расстоянии друг от друга и на расстоянии 2 см от края чашки. Одну чашку можно использовать для изучения чувствительности одного штамма к 4-5 антибиотикам.
Засеянные чашки с нанесенными на них дисками помещают в термостат при 37° С на 18-24 ч. Чашки ставят вверх дном, чтобы избежать попадания конденсационной воды на поверхность посевов.
Учет результатов. Действие антибиотиков оценивают по феномену задержки роста вокруг диска (рис. 25). Диаметр зон задержки роста микробов вокруг дисков определяют с помощью линейки, включая диаметр самого диска. Между степенью чувствительности микроба к антибиотикам и величиной зоны отсутствия роста имеются следующие соотношения (табл. 10).
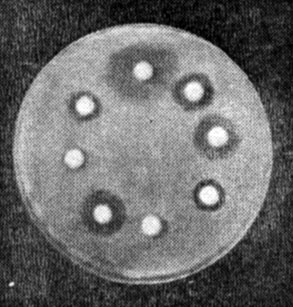
Рис. 25. Определение чувствительности бактерий к антибиотикам (метод дисков)
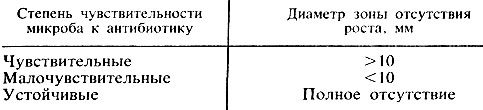
Таблица 10. Определение степени чувствительности микроорганизмов к антибиотикам по величине зоны отсутствия роста
В ответе указывают, какой чувствительностью обладает исследуемый штамм, а не размер зоны задержки роста.
В ряде случаев определяют чувствительность микроорганизмов к антибиотикам в нативном материале (гной, раневое отделяемое и др.). При этом материал наносят на поверхность питательного агара и равномерно растирают по поверхности стерильным стеклянным шпателем*, а потом накладывают диски. Метод дисков для определения чувствительности микроорганизмов вследствие простоты и доступности широко применяют в практических лабораториях и расценивают как качественный метод.
* (Для тех видов микроорганизмов, которые не растут на мясопептонном агаре, как, например, стрептококки, пневмококки и другие, применяют агар с кровью или сывороткой.)
Метод серийных разведений в жидкой питательной среде. Этот метод является точным количественным методом, его применяют в научной работе и в особо важных случаях в лабораториях больниц и профилактических учреждений.
Для постановки опыта необходимо иметь чистую культуру испытуемого микроорганизма, основной раствор антибиотика, мясопептонный бульон на переваре Хоттингера, содержащий 1,2-1,4 г/л аминного азота.
Активность антибиотиков выражают в ЕД/мл или мкг/мл. Для приготовления основного раствора антибиотика используют антибиотики, имеющиеся в продаже с указанием количества их во флаконе.
Если на этикетке вместо количества единиц во флаконе дозировка указана в единицах массы, то следует иметь в виду, что 1 г активности для большей части антибиотиков соответствует 1 млн. ЕД. Из этого раствора и должны быть приготовлены требуемые разведения антибиотиков. Указания для приготовления основного раствора антибиотиков на примере пенициллина приведены в табл. 11.

Таблица 11. Получение основного раствора пенициллина
Готовят взвесь культуры микроорганизмов, выросшей на плотной питательной среде. Полученную взвесь сравнивают с оптическим стандартом мутности № 10 (см. ниже), а затем разводят стерильным изотоническим раствором натрия хлорида до 106 микробных тел в 1 мл. Для получения соответствующего разведения микробной взвеси готовят ряд последовательных десятикратных разведений (см. ниже).
Постановка опыта. В 12 стерильных пробирок разливают по 1 мл жидкой питательной среды. В 1-ю пробирку вносят 1 мл основного раствора антибиотика, содержащего, например, 32 ЕД в 1 мл. Содержимое 1-й пробирки перемешивают и 1 мл переносят во 2-ю пробирку, из 2-й - в 3-ю, из 3-й - в 4-ю и так до 10-й, из которой 1 мл удаляют. Таким образом, 1-я пробирка будет содержать 16 ЕД, 2-я - 8 ЕД, 3-я - 4 ЕД и т. д. Для приготовления каждого разведения используют отдельную пипетку. Содержимое 11-й пробирки служит контролем роста бактерий, а 12-й - контролем стерильности питательной среды. Во все пробирки, кроме 12-й, вносят 0,1 мл испытуемой культуры определенной густоты. Посев инкубируют в термостате в течение 18-24 ч и регистрируют результаты опыта.
Учет результатов проводят при наличии роста в контроле культуры и отсутствии роста в контроле среды. Затем отмечают последнюю пробирку с полной видимой задержкой роста микробов. Количество антибиотика в этой пробирке является минимальной ингибирующей концентрацией для испытуемого штамма и определяет степень его чувствительности к данному антибиотику. В ответе, выдаваемом лабораторией, указывают минимальную ингибирующую концентрацию.
Метод серийных разведений на плотной питательной среде. Готовят двукратные разведения антибиотика, как и при методе серийных разведений в жидкой питательной среде. Затем берут 1 часть каждого разведения антибиотика и 9 частей питательного агара, расплавленного и охлажденного до 42° С (из расчета 1 мл антибиотика + 9 мл МПА), хорошо перемешивают и наливают в чашки Петри.
Густоту (концентрацию) культуры определяют по оптическому стандарту мутности № 10 и разводят стерильным изотоническим раствором до 107 микробных тел в 1 мл. Бактериальной петлей наносят испытуемые культуры на поверхность питательного агара с антибиотиком. На одну чашку делают посев 20-25 штаммов. Засеянные чашки ставят в термостат при 37° С на 16-20 ч для большинства видов микроорганизмов. Чашка с питательным агаром без антибиотика, на которую наносят испытуемые культуры, является контрольной.
Учет результатов проводят при наличии роста в контрольной чашке, а минимальную ингибирующую концентрацию антибиотика определяют по последней чашке Петри, где отмечают полную задержку роста бактерий.
Метод дорожки по Флемингу. Метод применяют для определения спектра действия антибиотика. В чашке Петри с МПА стерильным скальпелем вырезают дорожку шириной 1 см и удаляют ее. Затем в пробирку с растопленным и охлажденным до 42-45° С мясопептонным агаром вносят определенную концентрацию раствора антибиотика. Содержимое пробирки перемешивают и выливают в дорожку так, чтобы жидкость не выходила за ее пределы. После застывания агара перпендикулярно к дорожке засевают петлей культуры нескольких исследуемых микроорганизмов. Посевы помещают в термостат на 18-24 ч.
Учет результатов. Чувствительные к препарату культуры начинают расти лишь на некотором расстоянии от дорожки, нечувствительные растут до самого края.
