Вывод химических формул. расчеты по химическим уравнениям
Формулы веществ показывают, какие элементы и в каком количестве входят в состав вещества. Различают формулы простейшие и молекулярные. Простейшая формула выражает наиболее простой возможный атомный состав молекул вещества, соответствующий отношениям масс между элементами, образующими данное вещество. Молекулярная формула показывает действительное число атомов каждого элемента в молекуле ( для веществ молекулярного строения).
Для вывода простейшей формулы вещества достаточно знать его состав и атомные массы образующих данное вещество элементов.
ПРИМЕР 1. Найти простейшую формулу оксида хрома, содержащего 68,4 % (массовых) хрома.
Решение. Обозначим числа атомов хрома и кислорода в простейшей формуле оксида соответственно через Х и У. Атомные массы хрома и кислорода равны 52 и 16. Поэтому массы хрома и кислорода в составе оксида относятся как
52Х : 16У.
По условиям задачи это отношение равно 68,4: 31,6. Следовательно, 52Х : 16 У = 68,4: 31,6,
откуда Х: У = 68,4/ 52: 1,98 / 16 = 1,32 : 1,98.
Чтобы выразить полученное отношение целыми числами, разделим оба его члена на меньший из них
Х:У = 1,32 / 1,32 : 1,98 / 1,32 = 1 :1,5;
а затем умножая оба члена последнего на 2, получим: Х:У = 2 : 3.
Таким образом, простейшая формула оксида хрома Cr 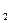 O
O 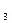 .
.
Для нахождения молекулярной формулы вещества необходимо кроме состава вещества знать его молекулярную массу.
ПРИМЕР 2. Газообразное соединение азота с водородом содержит 12,5 % (масс.) водорода. Плотность соединения по водороду равна 16. Найти молекулярную формулу соединения.
Решение. Находим отношение числа атомов азота Х к числу атомов водорода У в молекуле соединения:
Х : У = 87,5 / 14 : 12,5 / 1 = 6,25 : 12,5 = 1 : 2 .
Простейшая формула соединения NH 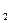 . Этой формуле отвечает молекулярная масса, равная 16. Истинную молекулярную массу вещества находим, исходя из его плотности по водороду:
. Этой формуле отвечает молекулярная масса, равная 16. Истинную молекулярную массу вещества находим, исходя из его плотности по водороду:
М = 2 × 16 = 32.
Таким образом, истинная молекулярная масса вещества вдвое больше вычисленной по его простейшей формуле. Следовательно, молекулярная формула соединения N 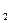 H
H 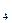 .
.
В уравнении химической реакции каждая формула изображает один моль соответствующего вещества. Поэтому, зная мольные массы участвующих в реакции веществ, можно по уравнению реакции найти соотношение между массами веществ, вступающих в реакцию и образующихся в результате ее протекания. Если в реакции участвуют вещества в газообразном состоянии, то уравнение реакции позволяет найти их объемные отношения.
ПРИМЕР 3. Хлор может быть получен действием серной кислоты на смесь диоксида марганца с хлористым натрием. Реакция протекает по уравнению:
2 NaCl + MnO 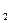 + 3 H
+ 3 H 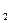 SO
SO 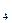 = 2 NaHSO
= 2 NaHSO 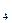 + MnSO
+ MnSO 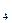 + Cl
+ Cl 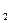 + H
+ H 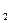 O.
O.
Какой объем хлора (условия нормальные) можно получить на 100 г хлорида натрия?
Решение. Согласно уравнению реакции, из 2 молей NaCl получается 1 моль хлора. Рассчитав массу 2 молей NaCl (117), составим пропорцию:
117 г NaCl дают 22,4 л Сl 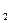 , 100 г NaCl - X л Cl
, 100 г NaCl - X л Cl 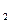
Cледовательно: Х = 22,4 × 100 / 117 = 19,15 л
РЕШИТЬ САМОСТОЯТЕЛЬНО ЗАДАЧИ 10-12
