Изучить строение молекул
1.1. Зарисовать структурную и геометрическую формулы молекулы оксида серы (VI) 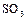 .
.
1.2. Зарисовать структурную и геометрическую формулы молекулы кислорода 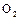 .
.
1.3. Зарисовать схему строения атомов кислорода и серы.
1.4. Зарисовать структурную и геометрическую формулы молекулы озона.
1.5. Зарисовать структурную и геометрическую формулы молекулы серы 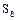 .
.
1.6. Зарисовать структурную и геометрическую формулы молекулы сероводорода.
1.7. Зарисовать структурную и геометрическую формулы молекулы сернистой кислоты 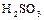 .
.
1.8. Зарисовать структурную и геометрическую формулы молекулы (диоксида серы) оксида серы (IV) 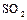 .
.
1.9. Зарисовать структурную и геометрическую формулы молекулы серной кислоты 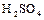 .
.
2. Наблюдать опыты и написать уравнения следующих реакций:
2.1. Горение лития.
2.2. Горение фосфора на воздухе.
2.3. Взаимодействие нитрата натрия с углём. Нитрат – ион в расплаве является окислителем.
2.4. Взаимодействие алюминия с серой. Образуется сульфид алюминия.
2.5. Взаимодействие цинка с серой. Образуется сульфид цинка.
2.6. Взаимодействие серы с концентрированной серной кислотой. Выделяется оксид серы (IV) 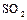 .
.
2.7. Взаимодействие хлорида железа (II) с сульфидом натрия. Образуется осадок сульфида железа (II).
2.8. Взаимодействие бромида свинца с сульфидом натрия. Выделяется сульфид свинца.
2.9. Взаимодействие брома с сульфидом натрия. Выделяется сера в виде белой мути.
2.10. Взаимодействия хлорида алюминия с сульфидом натрия. Образуется гидроксид алюминия и сероводород.
2.11. Взаимодействие сульфида натрия с сульфитом натрия. Выделяется сера в виде белого осадка.
2.12. Взаимодействие сульфида натрия с бихроматом калия. Образуется раствор сульфата хрома (III) 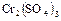 .
.
2.13. Взаимодействие меди с серной кислотой. Выделяется сернистый газ.
2.14. Взаимодействие сульфита натрия с бихроматом калия. Образуется сульфат хрома (III).
2.15. Разложение медного купороса 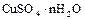 .
.
2.16. Взаимодействие хлорида бария с сульфатом натрия. Сульфат бария выделяется в виде осадка.
2.17. Разложение перманганата калия.
2.18. Окисление оксида серы (IV).
2.19. Обжиг пирита в кипящем слое 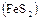 .
.
В каждой окислительно-восстановительной реакции проставить степени окисления и записать полуреакции.
Написать названия соединений в химических реакциях.
Приложение
К элементам VI группы главной подгруппы А относятся типические элементы: 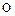 – кислород,
– кислород, 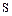 – сера и элементы подгруппы селена:
– сера и элементы подгруппы селена: 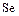 – селен,
– селен, 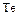 – теллур,
– теллур, 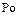 – полоний.
– полоний.
Электронные формулы:
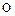 -
- 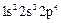 (кислород);
(кислород);
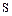 -
- 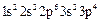 (сера);
(сера);
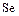 -
- 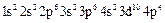 (селен);
(селен);
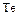 -
-  (теллур);
(теллур);
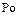 -
- 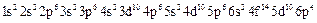 (полоний).
(полоний).
В ряду 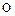 ,
, 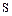 ,
, 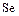 ,
, 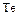 ,
, 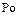 уменьшаются энергии ионизации, увеличиваются размеры атомов и ионов. Это ослабляет неметаллические признаки элементов и увеличивает металлические:
уменьшаются энергии ионизации, увеличиваются размеры атомов и ионов. Это ослабляет неметаллические признаки элементов и увеличивает металлические: 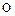 – кислород,
– кислород, 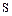 – сера – элементы неметаллы,
– сера – элементы неметаллы, 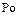 - полоний – металл.
- полоний – металл.
Элементы VI А подгруппы имеют конфигурацию валентных электронов 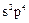 . В образовании связей вовлекаются непарные электроны, а также одна или две электронные пары. Поэтому наиболее устойчивые четные степени окисления: -2; +2; +4; +6.
. В образовании связей вовлекаются непарные электроны, а также одна или две электронные пары. Поэтому наиболее устойчивые четные степени окисления: -2; +2; +4; +6.
Кислород – самый распространённый элемент на Земле. По распространённости в Космосе кислород уступает только водороду и гелию. Кислород образует соединения почти со всеми элементами (кроме гелия, неона, аргона). Вследствие количественного преобладания и большой окислительной активности кислород предопределяет форму существования на Земле химических элементов. Известно свыше 1400 минералов, содержащих кислород. По электроотрицательности кислород уступает только фтору 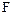 , степень окисления кислорода в подавляющем большинстве соединений равна
, степень окисления кислорода в подавляющем большинстве соединений равна
-2 ( 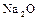 ,
, 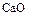 ,
, 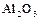 ,
, 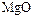 . Кроме того, кислород проявляет степени окисления +2 и +4, а также +1 и -1 в соединениях со связью
. Кроме того, кислород проявляет степени окисления +2 и +4, а также +1 и -1 в соединениях со связью 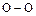 .
.
Степени окисления +2; +1; 0 проявляются у кислорода в его соединениях со фтором, например: дифторид кислорода 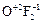 ; диоксидифторид
; диоксидифторид 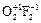 :
: 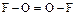 ; нитрофторид
; нитрофторид 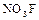 :
: 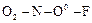 .
.
Дифторид кислорода 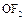 получают при быстром пропускании фтора через 2%-ный раствор щелочи:
получают при быстром пропускании фтора через 2%-ный раствор щелочи:
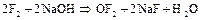
Дифторид кислорода – ядовитый газ бледно-желтого цвета; термически устойчив, сильный окислитель.
Диоксидифторид 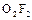 образуется при взаимодействии простых веществ в электрическом разряде:
образуется при взаимодействии простых веществ в электрическом разряде:
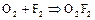
Соединение крайне неустойчиво, что определяется низкой энергией разрыва связи 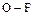 (75 кДж/моль).
(75 кДж/моль).
В качестве производного, в котором кислород проявляет степень окисления +4, можно рассматривать аллотропическую (аллотропную) модификацию кислорода – озон 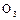
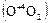 . Молекула озона диамагнитна, имеет угловую форму и обладает некоторой полярностью (m=0,17×10-29 Кл×м).
. Молекула озона диамагнитна, имеет угловую форму и обладает некоторой полярностью (m=0,17×10-29 Кл×м).
Озон – газ синего цвета с резким раздражающим запахом, очень токсичен. Жидкий озон – темно-синяя жидкость, твердый – темно-фиолетовые кристаллы (Т пл. -192,7°С). Поскольку молекула 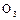 обладает полярностью и большей поляризуемостью, озон имеет более высокую температуру кипения (-111,9°С), чем кислород.
обладает полярностью и большей поляризуемостью, озон имеет более высокую температуру кипения (-111,9°С), чем кислород.
Как сильный окислитель, к тому же экологически «чистый», озон используется для очистки питьевой воды, для дезинфекции воздуха в различных органических синтезах, для очистки морей от разлитой нефти.
Степень окисления -1 кислород проявляет в пероксидных соединениях. Наибольшее практическое значение имеет пероксид водорода (перекись) 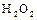 . Строение молекулы
. Строение молекулы 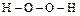 (но не линейное, а угловое).
(но не линейное, а угловое).
Пероксид – сильный окислитель. Водные растворы пероксида водорода широко используется для отбеливания различных материалов. Для обеззараживания сточных вод. При действии концентрированных растворов перекиси на бумагу, опилки или другие горючие вещества происходит их самовоспламенение. Пероксид водорода применяют как окислитель ракетного топлива.
Восстановительные свойства 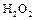 проявляет по отношению к таким сильным окислителям, как ионы
проявляет по отношению к таким сильным окислителям, как ионы 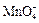 :
:
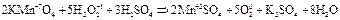
Сера– типичный неметаллический элемент. По электроотрицательности уступает только галогенам, кислороду и азоту. Наиболее устойчивы, как уже говорилось, четные степени окисления серы (-2,+2,+4,+6). Наиболее характерны для серы высшая и низшая степени окисления. Известны соединения серы почти со всеми элементами. Сера – весьма распространенный на Земле элемент. По распространённости в Космосе сера занимает 9 место после 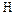 ,
, 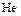 ,
, 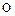 ,
, 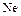 ,
, 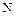 ,
, 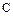 ,
, 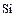 ,
, 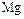 . Сера – биогенный элемент, входит в состав белков. Она содержится в нефти, углях, природных газов.
. Сера – биогенный элемент, входит в состав белков. Она содержится в нефти, углях, природных газов.
В соответствии с характерными степенями окисления сера в природе встречается в виде сульфидных ( 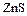 ,
, 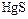 ,
, 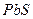 ,
, 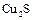 ,
, 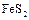 ,
, 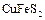 и др.) и сульфатных (
и др.) и сульфатных ( 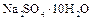 ,
, 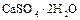 ,
, 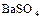 и др.) минералов, а также в самородном состоянии. Серу получают, главным образом, выплавкой самородной серы непосредственно в местах её залегания под землёй. Она применяется в производстве серной кислоты, для вулканизации каучука. Как инсектицид в сельском хозяйстве и т.д.
и др.) минералов, а также в самородном состоянии. Серу получают, главным образом, выплавкой самородной серы непосредственно в местах её залегания под землёй. Она применяется в производстве серной кислоты, для вулканизации каучука. Как инсектицид в сельском хозяйстве и т.д.
Один и тот же элемент может образовывать несколько разных типов простых веществ, называемых аллотропными модификациями. Явление аллотропии может быть обусловлено либо различным составом молекул простого вещества данного элемента (аллотропия состава), либо способом размещения молекул или атомов в кристаллах (аллотропия формы).
Сера, в отличие от кислорода, способна образовывать аллотропные модификации (гомоцепи) 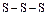 , имеющие зигзагообразную форму (рис.1), поскольку в их образовании принимают участие электроны взаимно перпендикулярно расположенных р-орбиталей атома. Наиболее стабильны циклические молекулы
, имеющие зигзагообразную форму (рис.1), поскольку в их образовании принимают участие электроны взаимно перпендикулярно расположенных р-орбиталей атома. Наиболее стабильны циклические молекулы 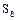 , имеющие форму короны (рис.2).
, имеющие форму короны (рис.2).
Возможны молекулы 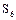 ,
, 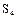 и с открытыми цепями
и с открытыми цепями 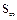 (пластическая сера, малоустойчивая).
(пластическая сера, малоустойчивая).
Две устойчивые в обычных условиях модификации: ромбическая a - 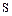 (плотность 2,07 г/см3; Т пл. – 112,8ºС) и моноклинная b -
(плотность 2,07 г/см3; Т пл. – 112,8ºС) и моноклинная b - 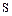 (плотность 1,96 г/см3; Т пл. – 119,3ºС) (
(плотность 1,96 г/см3; Т пл. – 119,3ºС) ( 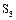 ). Неустойчивые модификации:
). Неустойчивые модификации: 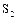 (пурпурная);
(пурпурная); 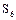 (оранжево-желтая) и др.
(оранжево-желтая) и др.
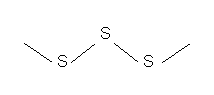
Рис. 1. Аллотропная модификация серы (гомоцепь)
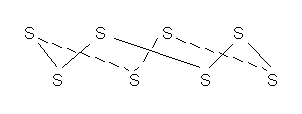
Рис. 2. Аллотропная модификация серы 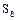
Если нагревать расплавленную серу, она превращается в легко подвижную жидкость желтого цвета, при температуре t=160ºС темнеет и её вязкость повышается, при температуре 200ºС сера становится темно-коричневой и вязкой, как смола (кольцевые молекулы 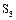 разрушаются и образуются цепи
разрушаются и образуются цепи 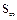 ). При температуре выше 250ºС цепи разрываются и жидкость снова становится подвижной. При 444,6ºС сера закипает.
). При температуре выше 250ºС цепи разрываются и жидкость снова становится подвижной. При 444,6ºС сера закипает.
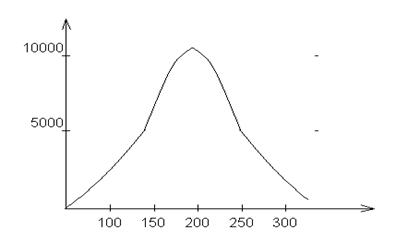
Вязкость серы h=1 при t=100ºС. Около 190ºС h вязкость примерно в 9000 раз больше, чем при 160ºС (см. рис. 3).
Сера – достаточно активный неметалл. Даже при умеренном нагревании она окисляет многие простые вещества, но и сама довольно легко окисляется кислородом и галогенами:
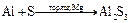 сульфид алюминия
сульфид алюминия
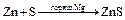 cульфид цинка
cульфид цинка
Сера диспропорционирует:
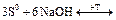
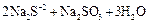
В технике оксид серы (VI) получают окислением 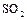 в присутствии катализатора (платина или оксид ванадия):
в присутствии катализатора (платина или оксид ванадия):
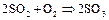
а также обжигом пирита:
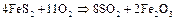
h
tºC
Рис. 3. Зависимость вязкости серы от температуры
Диоксиды серы 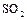 применяют для получения серной кислоты; в бумажном и текстильном производстве в качестве отбеливающего средства, для консервации плодов. Жидкий
применяют для получения серной кислоты; в бумажном и текстильном производстве в качестве отбеливающего средства, для консервации плодов. Жидкий 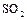 используют в качестве неводного растворителя для проведения различных синтезов.
используют в качестве неводного растворителя для проведения различных синтезов.
Малоактивные металлы 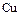 ,
, 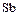 и др., а также бромоводород и некоторые неметаллы восстанавливают концентрированную серную кислоту до
и др., а также бромоводород и некоторые неметаллы восстанавливают концентрированную серную кислоту до 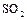 :
:
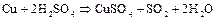
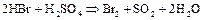
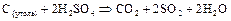
Активные металлы ( 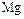 ,
,  и т.п.) восстанавливают концентрированную
и т.п.) восстанавливают концентрированную 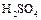 до свободной серы или сероводорода:
до свободной серы или сероводорода:
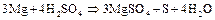
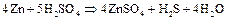
При нагревании сульфиты диспропорционируют:
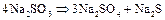
Ион 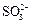 легко переходит в ион
легко переходит в ион 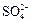 т.к. обладает довольно сильными восстановительными свойствами:
т.к. обладает довольно сильными восстановительными свойствами:
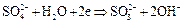 ,
, 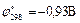 .
.
Сульфиты в растворах постепенно окисляются даже кислородом воздуха:
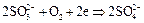
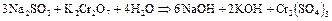
[гидролиз 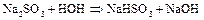 ]
]
Сера (IV) при взаимодействии с более сильным восстановителем проявляет окислительные свойства:
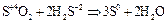
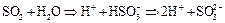
В щелочной среде легко смещается вправо:
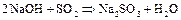
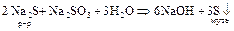

[гидролиз 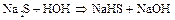 ]
]
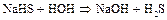
Сера в высшей степени окисления +6 образует различные соединения, из которых наибольший интерес представляет серная кислота. Концентрированная серная кислота является окислителем за счет серы (VI). Разбавленная серная кислота окисляет своим ионом водорода.
