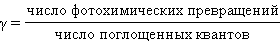Экспериментальные методы определения констант скорости химической реакции
Реакции первого порядка.Примером такой реакции являются реакции, в которых происходит химическое превращение одной молекулы (изомеризация, диссоциация и т. д.):
H2S → H2 + S
Для реакций первого порядка кинетическое уравнение имеет следующий вид:
V = 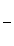
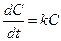
Роль концентрации при радиоактивном распаде играет количество радиоактивных атомов N. Заменив в предыдущем уравнении концентрацию на количество атомов и перенеся члены уравнения, включающие N, влево, время — вправо (эта операция называется разделением переменных), получим:
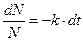
Интегрируя полученное уравнение по времени от 0 до t и по числу атомов от N0 до Ntполучим:
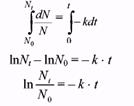
Потенцируя это уравнение, получим:
Nt = Nо ּe-kt
Уравнение Аррениуса, записанное через разность логарифмов, представляет уравнение прямой в координатах 1n N — время. В общем случае для реакции первого порядка выполняется аналогичная зависимость ln С — t. Построив соответствующий график (Рис.7.6), определим значение константы скорости для реакции первого порядка, как тангенс угла наклона прямой.
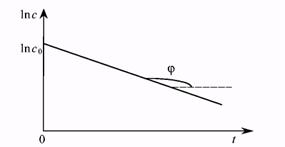
Рис. 7.6. Определение константы скорости реакции первого порядка.
Реакции второго порядка.Реакция димеризации ацетилена
2 С2Н2 =С4Н4
является реакцией второго порядка. Кинетическое уравнение этой реакции имеет следующий вид:
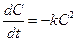
Проведя разделение переменных и проинтегрировав обе части уравнения в тех же пределах, что и в уравнении реакции первого порядка, получим
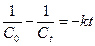
Если ввести следующие обозначения: у =1/Ct ; х = t; А =k; В =1/C0,
то уравнение представляет собой уравнение прямой у = А • х + В. Отложив по оси ординат 1/C, а по оси абсцисс время, и построив экспериментальную прямую (рис.7.7), аналогичную прямой, приведенной на рис. 7.6, найдем значение константы скорости для реакции второго порядка, как тангенс угла ее наклона. Наклон построенной прямой будет противоположен наклону прямой на рис. 7.6, так как при уменьшении концентрации со временем обратная ей величина возрастает. 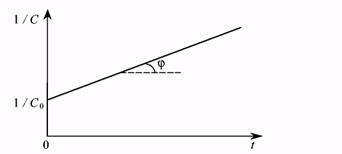
Рис. 7.7. Определение константы скорости реакции второго порядка.
Для рассмотрения реакции третьего порядка можно получить соответствующие соотношения, используя приведенный выше подход.
Из рис. 7.8, на котором приведены зависимости изменения концентрации от времени протекания реакции для различных порядков, видно, что наиболее резко концентрация вещества меняется со временем в реакции первого порядка, более медленно в реакции 2-го порядка и т.д. Здесь принимается, что значения констант скорости для всех порядков численно равны.
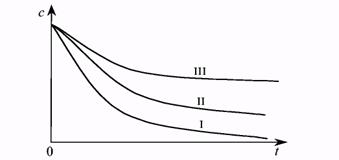
Рис. 7.8. Изменение концентрации реагента в реакциях первого -третьего порядков в зависимости от времени протекания реакции.
Размерность константы скорости.В зависимости от порядка реакции меняется и размерность константы скорости. Для реакции I-го порядка, подставив размерность скорости и концентрации в соответствующее уравнение, получим:
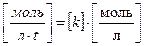
отсюда
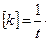
По аналогии, для константы скорости реакции второго порядка, имеем:

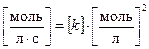
откуда получаем:
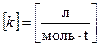
7. 4 Сложные реакции 
Реакции, протекающие в одну стадию, называют простыми (элементарными) реакциями, а реакции, включающие несколько стадий - сложными. Энергетическая диаграмма простой реакции приведена на рис. 7.9 (а), сложной (двухстадийной) - на рис. 7.9 (б).
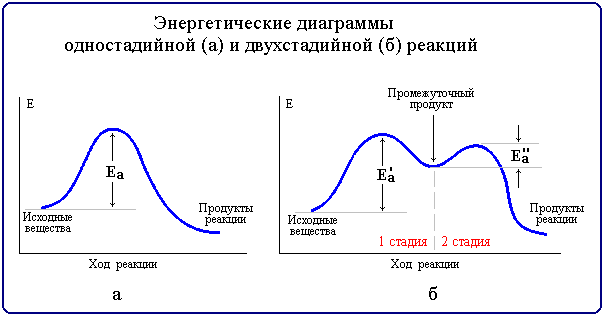
Рис. 7.9. Энергетические диаграммы
Так, например, многие органические реакции являются сложными и идут в несколько элементарных стадий (последовательных или параллельных). Общая скорость сложной химической реакции определяется скоростью ее наиболее медленной (лимитирующей) стадии. Например, в приведенной на рис. 7.9(б) диаграмме лимитирующей является стадия 1 с более высокой энергией активации Еа'. К кинетически сложным реакциям относят такжепоследовательные, параллельные, сопряженные, цепные, фотохимические и некоторые другие.
Фотохимические реакции 
Реакции, протекающие под воздействием светового излучения, называются фотохимическими, а раздел, изучающий фотохимические превращения, – фотохимией.
Основной закон фотохимии – закон квантовой эквивалентности (А. Эйнштейн, 1912 г): каждый поглощенный квант света hν вызывает изменение одной молекулы.
Важнейшим параметром фотохимической реакции служит квантовый выход γ:
|
В зависимости от типа фотохимической реакции квантовый выход может меняться в широких пределах. Это связано с возможностью потери поглощенной энергии до фотопревращения. Если время существования фотовозбужденной молекулы и скорость фотодиссоциации совпадают, то γ ~ 1. При γ >> 1 фотореакция идет по цепному механизму. В частности для реакции H2 + Cl2 = 2HCl γ = 105.
Типы фотохимических реакций:
1. Фотодиссоциация (фотолиз) приводит к разложению исходного вещества, поглотившего световую энергию. Примерами реакции фоторазложения служат такие: разложение галогенидов серебра (основа серебряной фотографии), фотолиз паров ацетона CH3CO CH3 → CO + другие продукты.
2. Фотосинтез приводит к образованию более сложных соединений. Примерами реакций фотосинтеза служат:
· фотосинтез озона в верхних слоях атмосферы, создающий защитный озоновый слой:
фотодиссоциация: 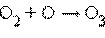
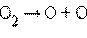 | ||
| Фотосинтез: |
· фотосинтез органических соединений из углекислого газа, воды, минеральных веществ зелеными растениями. В частности, синтез глюкозы может быть описан уравнением:
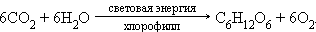 |
Последовательные реакции 
Последовательными называют реакции с промежуточными стадиями, когда продукт предыдущей стадии служит исходным веществом для последующей:
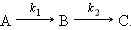 |
Например, последовательный гидролиз карбоксильных групп диалкилоксалатов:
AlkylO2C-CO2Alkyl + H2O → AlkylO2C-CO2H + H2O → HO2C-CO2H
Параллельные реакции 
Реакции, в которых исходные вещества способны образовывать разные продукты реакции или одно вещество одновременно способно реагировать с несколькими веществами, называются параллельными.
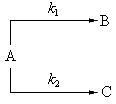
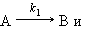
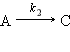
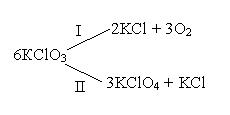
Например, при нагревании хлората калия одновременно могут протекать реакция разложения (I) и диспропорционирования (II):
Сопряженные реакции
Сопряженные реакции – это две реакции, одна (I) из которых может протекать совместно с другой (II), т.е. она индуцируется последней:
А + В → М (I) 2HI + H2O2 = 2H2O + I2
A + C → N (II) 2FeSO4 + H2O2 = 2Fe(ОН)SO4
Вещество С (FeSO4) служит индукторомпервой реакции. Механизм химической индукции заключается в участии одних и тех же промежуточных . активных частиц в каждой из двух сопряженных реакций. Одна из реакций порождает такие частицы в количестве, достаточном для квазистационарного течения обеих реакций. Реакцию ведут радикалы 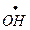 , образующиеся при окислении пероксидом Fe2+ до Fe3+ . В этом примере сопряженная реакция - окисление HI и окисление Fe2+ , обе реакции идут с участием
, образующиеся при окислении пероксидом Fe2+ до Fe3+ . В этом примере сопряженная реакция - окисление HI и окисление Fe2+ , обе реакции идут с участием 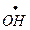 . Полная схема механизма взаимодействия:
. Полная схема механизма взаимодействия:
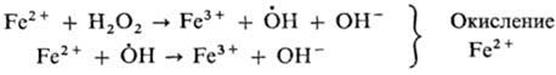
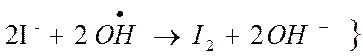
 Окисление иода
Окисление иода
Реакция (II) может индуцировать протекание других реакций окисления. Например, взаимодействие бензола с перекисью водорода протекает с участием в качестве индуктора сульфата железа, аналогичным образом генерирующего гидроксид-радикалы:
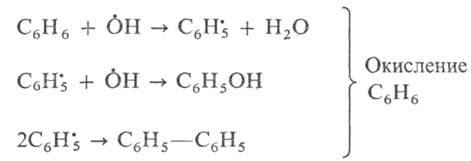
Цепные реакции
Реакции, в которых возможность протекания каждого элементарного акта взаимодействия между активными молекулами реагирующих веществ обусловлена успешным исходом предыдущего акта и, в свою очередь, обусловливает возможность последующего называются цепными.
К ним относят реакции, протекающие с образованием свободных радикалов, способных превращать реагенты в конечные продукты, поддерживая постоянство свободных радикалов или даже увеличивая их (разветвленная цепная реакция).
В цепных реакциях выделяют три стадии: зарождение (иницирование) цепи, ее развитие (продолжение, рост) и обрыв. Зарождение происходит под воздействием светового, радиационного, термического или другого воздействия.
Примером неразветвленной цепной реакции,в которой взаимодействие инициированного радикала с молекулой вещества приводит к возникновению одного нового, может служить H2 + Br2 = 2HBr. Зарождение цепи осуществляется термо- и фотодиссоциацией:
зарождение цепи:
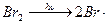
рост цепи (развитие):
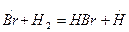
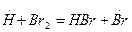
обрыв цепи: 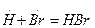
Акт последовательности (I) + (II), называемый звеном цепи, продолжается дальше и число звеньев может достигать сотен тысяч (длина цепи). Стадия цепного процесса, приводящая к исчезновению радикалов, называется обрывом цепи. Цепь может оборваться в результате соударения двух радикалов (III) или в результате взаимодействия радикала с поверхностью стенки сосуда.
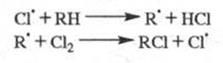
По цепному механизму протекает реакция хлорирования углеводородов:
Cl2 + 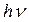 → 2Cl
→ 2Cl
В разветвленных цепных реакциях взаимодействие свободного радикала с молекулой исходного вещества приводит к образованию не одного а двух и большего числа новых. Один из них продолжает старую цепь, а другие дают начало новым; цепь разветвляется, и реакция прогрессивно ускоряется. Горение водорода относится к разветвленным цепным реакциям:
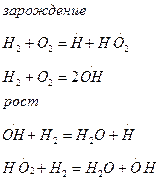
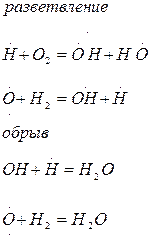

| По цепному механизму протекают многие реакции горения, полимеризации, окисления, термического разложения. К цепным процессам относятся и ядерные цепные реакции,протекающие в атомных реакторах или при взрыве атомной бомбы. Роль активной частицы в этом случае играет нейтрон, проникновение которого в атомное ядро может приводить к его распаду, сопровождающемуся образованием новых свободных нейтронов, продолжающих разветвленную цепь ядерных превращений, и выделением большого количества энергии. |
Химическое равновесие
Кинетическое химическое равновесие – состояние химической системы, при котором возможны реакции, идущие с равными скоростями в противоположных направлениях. При химическом равновесии концентрации реагентов, температура и другие параметры системы не изменяются со временем.
Необратимые и обратимые реакции.Если слить растворы кислоты и щелочи, образуется соль и вода, например,
HCl + NaOH = NaCl + H2O, и если вещества были взяты в нужных пропорциях, раствор имеет нейтральную реакцию и в нем не остается даже следов соляной кислоты и гидроксида натрия. Если попытаться провести реакцию в растворе между образовавшимися веществами – хлоридом натрия и водой, то никаких изменений не обнаружится. В подобных случаях говорят, что реакция кислоты со щелочью необратима, т.е. обратная реакция не идет. Практически необратимы при комнатной температуре очень многие реакции, например,
H2 + Cl2 = 2HCl, 2H2 + O2 = 2H2O и др.
Необратимые реакции протекают до конца – до полного израсходования одного из реагирующих веществ. Обратимые реакции протекают не до конца: при обратимой реакции ни одно из реагирующих веществ не расходуется полностью.
Многие реакции обратимы уже в обычных условиях, это означает, что в заметной степени протекает обратная реакция. Например, если попытаться нейтрализовать щелочью водный раствор очень слабой хлорноватистой кислоты, то окажется, что реакция нейтрализации до конца не идет и раствор имеет сильнощелочную среду. Это означает, что реакция HClO + NaOH  NaClO + H2O обратима, т.е. продукты этой реакции, реагируя друг с другом, частично переходят в исходные соединения. В результате раствор имеет щелочную реакцию. Обратима реакция образования сложных эфиров (обратная реакция называется омылением):
NaClO + H2O обратима, т.е. продукты этой реакции, реагируя друг с другом, частично переходят в исходные соединения. В результате раствор имеет щелочную реакцию. Обратима реакция образования сложных эфиров (обратная реакция называется омылением):
RCOOH + R'OH  RCOOR' + H2O, многие другие процессы.
RCOOR' + H2O, многие другие процессы.
Как и многие другие понятия в химии, понятие обратимости во многом условно. Обычно необратимой считают реакцию, после завершения которой концентрации исходных веществ настолько малы, что их не удается обнаружить (конечно, это зависит от чувствительности методов анализа). При изменении внешних условий (прежде всего температуры и давления) необратимая реакция может стать обратимой и наоборот. Так, при атмосферном давлении и температурах ниже 1000° С реакцию
2Н2 + О2 = 2Н2О
еще можно считать необратимой, тогда как при температуре 2500° С и выше вода диссоциирует на водород и кислород примерно на 4%, а при температуре 3000° С – уже на 20%. В конце 19 в. немецкий физикохимик Макс Боденштейн (1871–1942) детально изучил процессы образования и термической диссоциации иодоводорода:
H2 + I2  2HI
2HI
Изменяя температуру, он мог добиться преимущественного протекания только прямой или только обратной реакции, но в общем случае обе реакции шли одновременно в противоположных направлениях.