Задачи для подготовки к экзамену
1. Получена смесь азота и водорода и установлены условия реакции. Равновесие в системе:
2 6 4 (вступило в реакцию и образовалось)
N2 + 3H2 ↔ 2NH3
1 2 4 (концентрации в равновесии)
- установилось при следующих концентрациях веществ
[N2]= 1 моль\л
[H2]=2 моль\л
[NH3]=4 моль\л
Вычислите исходные концентрации N2 и H2 , а также константу химического
равновесия
Ответ: 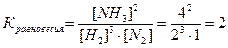
[N2]исходная = 1 моль\л +2 моль\л = 3 моль\л
[H2]исходная = 2 моль\л +6 моль\л = 8 моль\л
2. Концентрация хлорноватистой кислоты (HClO) в водном растворе равна 0,001 моль\л.
• Вычислите степень диссоциации кислоты, концентрацию ионов водорода и рН раствора, если константа диссоциации кислоты Кдисс=10-7
α= 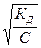 = 10-2 или 1% . рН= -lg
= 10-2 или 1% . рН= -lg 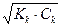 = 5. [H+] =
= 5. [H+] = 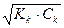 = 10-5
= 10-5
2а. Определите степень диссоциации, рН среды и концентрацию протонов в водном растворе NH4OH , концентрация которого равна 0,001 моль\л , Кдисс=10-5
α= 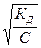 = 10-1 или 10% . рОН= -lg
= 10-1 или 10% . рОН= -lg 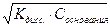 = 4.
= 4.
[ОH-] = 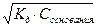 = 10-4
= 10-4
рН = 14 – рОН = 14 -4 =10 [H+] = 10-10 моль/л
3. Вычислить DН реакции :
N2H4 + O2 = N2 + 2H2O
(газ) (газ) (газ) (газ)
если DН0обр , кДж\моль, N2H4(г)= -80 H2O(г)= -242
Определите знак DS реакции, и может ли быть осуществлена эта реакция в стандартных условиях (возможность самопроизвольного протекания)
DrH0298 = ∑vi · DfH0298,i - ∑vj ·DfH0298,j = 0 + 2(-242) – (-80 + 0) =-404 кДж
прод. исход.
где DrH0298 — тепловой эффект химической реакции
DS реакции больше нуля (DrS>0), так как количество газовых молекул до реакции равно 2, а после – 3, т.е. увеличилось. Оба слагаемых в уравнении DG = DН-ТDS отрицательны при любых температурах и DrG <0, поэтому возможно самопроизвольное протекание прямой реакции
4. Определите осмотическое давление раствора в 500 мл которого содержится 4,5г фруктозы C6H12O6 (R = 0,082 л.атм/град.моль)
Используем уравнение Вант-Гоффа РОСМ. = СМRT или РОСМ. = nRT/V, n =m/M Рассчитываем М (C6H12O6) = 6 ·12 + 12·1 + 6·16 = 180, V = 0,5 л
Ответ: Росм. = 1,22 атм.
5. В 250 мл воды растворили 60г мочевины CO(NH2)2. Определите температуру замерзания полученного раствора, если криоскопическая постоянная воды К=1,86.
Используем закон Рауля:ΔТзам. = КТ. Сm,
где ΔТзам. – понижение температуры замерзания раствора по сравнению с температурой замерзания чистого растворителя, Сm – моляльная концентрация раствора, КТ – криоскопическая постоянная
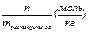 Моляльная концентрация – это химическое количество вещества, растворенное в одном килограмме растворителя:
Моляльная концентрация – это химическое количество вещества, растворенное в одном килограмме растворителя:
• Cm = = m/M.mрастворителя = 4 моль/кг
ΔТзам. = КТ. Сm = 4.1,86 = 7,440
6. Определите, в какой среде - кислой, нейтральной или щелочной – сильнее проявляются окислительные свойства иона MnO4 -. Напишите соответствующие уравнения полуреакций восстановления ионов MnO4 – и по таблице найдите величины окислительно-восстановительных потенциалов
Е = Е0 + (0,059/n) . lg ([Ox]/[Red])
В кислых:
KMnO4 + KNO2 + H2SO4 = MnSO4 + K2SO4 + KNO3 + H2O
MnO4- + 8H+ + 5e = Mn2+ + 4H2O 2 восстановление
NO2- + H2O - 2e = NO3- + 2H+ 5 окисление
Сложим первое уравнение полуреакции, умножив на 2, со вторым, умноженным на 5
2MnO4- + 16H+ + 10e +5NO2- + 5H2O - 10e = 2Mn2+ + 8H2O + 5NO3- + 10H+
Сокращаем коэффициенты с одинаковыми ионами и электронами:
2MnO4- + 6H+ +5NO2- = 2Mn2+ + 3H2O + 5NO3-
2KMnO4 + 5KNO2 + 3H2SO4 = 2MnSO4 + K2SO4 + 5KNO3 + 3H2O Е0 MnO4- / Mn2+ = 1,51 В
В нейтральных:
KMnO4 + K2SO3 + H2O = MnO2 + K2SO4 + КОH
2KMnO4 + 3K2SO3 + H2O = 2MnO2 + 3K2SO4 + 2КОH Е0 MnO4- / MnO2 = 0,60 В
В основных:
а) KMnO4 + K2SO3 + KOH = K2MnO4 + K2SO4 + H2O Е0 MnO4- / MnO4-2 = 0,56 В
б) KMnO4 +СН3ОН +KOHэлектронами =К2MnO4+ K2СO3 + H2O
а) 2KMnO4 + K2SO3 + 2KOH = 2K2MnO4 + K2SO4 + H2O
б) 6KMnO4 +СН3ОН +8KOHэлектронами =6К2MnO4+ K2СO3 + 6H2O
7. На основании величин стандартных электродных окислительно-восстановительных
потенциалов (таблица) ,укажите, в каком направлении может самопроизвольно
протекать реакция:
Cl2+2KF ↔ 2KCl+F2
Cl2+2e- ↔ 2Cl- окислитель восстанавливается
2F- -2e- ↔ F2 восстановитель окисляется
Сравним стандартные электродные потенциалы: E Cl2/Cl- = 1,36 B < E F2/F- = 2,87 B. Окислителем может быть фтор. Реакция потечет в обратном направлении
8. На основании концепции гибридизации атомных орбиталей ,определите
геометрическую конфигурацию молекул BeCl2, РF3 и ВF3 ,полярность, типы межмолекулярного взаимодействия
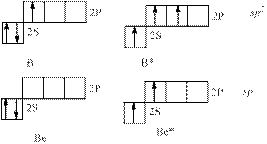
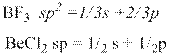

Mолекулы BeCl2 и ВF3 симметричны, значит их суммарный дипольный момент равен нулю и они неполярны. Между молекулами может наблюдаться только дисперсионное взаимодействие
Р фосфор (основное состояние) РF3, фосфор находится в одной подгруппе с азотом и является его элементом-аналогом sp3 – искаженный тетраэдр, молекула полярна, как и молекулы NH3, NF3. Между молекулами этих соединений возможно все типы межмолекулярного взаимодействия: ориентационное, индукционное и дисперсионное
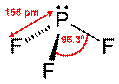
9. Вычислите степень гидролиза ацетата калия в 0,001 М растворе этой соли , и значение рН раствора. Напишите уравнение гидролиза. Кдисс(CH3COOH) = 10-5
CH3COOK + H2O ↔ CH3COOH + KOH
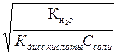 α=
α= 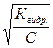 = = 10-3
= = 10-3
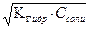 |
рОН = - lg = 6
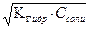 |
pH = 14 – рОН = 14 + lg = 8
10. Определить рН среды 0,1 М растворов солей: 1)NH4Cl, Кдис. (NH4OH) = 10-5.
2)Na2CO3 (карбонат натрия), Кдисс1 (Н2CO3) = 10-7 , Кдисс2 (Н2CO3) = 10-11
Соли сильные электролиты и полностью диссоциируют на ионы
NH4Cl →NH4+ + Cl- соль образована слабым основанием
NH4+ + НОН ↔ NH4OH + Н+ гидролиз по катиону, кислая среда
pH = -lg 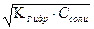 = = -lg
= = -lg 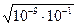 = 5
= 5
Na2CO3 → 2Na+ + CO32- соль образована слабой кислотой
CO32- + НОН ↔ НCO3- + ОН- первая стадия гидролиза по аниону которой соответствует константа гидролиза равная частному от деления ионного произведения воды на константу диссоциации второй стадии угольной кислоты:
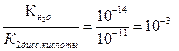 | |||
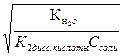 | |||
Кг1 = α1г = 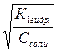 = = 10-1= 0,1
= = 10-1= 0,1
НCO3- + НОН ↔ Н2CO3 + ОН- вторая стадия гидролиза по аниону которой соответствует константа гидролиза равная частному от деления ионного произведения воды на константу диссоциации первой стадии угольной кислоты:
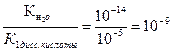 |
Кг2 = α2г = 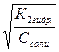 =
= 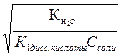 = 10-4
= 10-4
Так как константа гидролиза первой стадии в миллион раз больше константы гидролиза второй стадии, а степень гидролиза по первой стадии в тысячу раз больше, чем по второй и при расчете рН раствора гидролизом по второй стадии можно пренебречь:
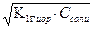 |
• рОН = - lg = 2
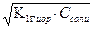 |
pH = 14 – рОН = 14 + lg =12
11. Определите концентрацию ионов ОН – в насыщенном водном растворе малорастворимого Al(OH)3, если ПР (Al(OH)3) = 27∙10-8. Определите рН раствора.
x x 3x
Al(OH)3 → Al+3 + 3OH-
ПР (Al(OH)3)= [Al+3]∙[OH-]3 = x∙(3x)3 = 27x4 = 27∙10-8, x = 10-2 , [OH-] = 3∙10-2
рОН = 1,52 рН = 14 – рН = 14 – 1,52 = 12,48
12. Определите знак DS0 для приведенных ниже реакций. С учетом знака DН0 , указанного
для каждой реакции, оцените, какие из реакций могут протекать самопроизвольно,
и при каких температурах (высоких или низких) это возможно :
a) 2N2 + O2 = 2N2O; DН0 >0 ΔS < 0, ΔG > 0, реакция невозможна
б ) N2 + O2 = 2NO; DН0 >0 ΔS = 0, ΔG > 0, реакция невозможна
в ) 2NO + O2 = 2NO2; DН0 <0 ΔS < 0, возможна при низких температурах
г) NO + NO2 = N2O3; DН0 <0 ΔS = 0, ΔG < 0 возможна при любой температуре
Все вещества находятся в газовой фазе
13. Определите молярную и нормальную (эквивалентную) концентрацию раствора серной кислоты, в котором массовая доля кислоты составляет 35%, а плотность 1,20г/мл.
Молярная концентрация – это химическое количество вещества, содержащееся в одном литре раствора: СМ = 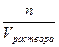 . Пусть Vраствора = 1л, тогда СМ = n =
. Пусть Vраствора = 1л, тогда СМ = n = 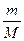 , масса вещества, выраженная через массовую долю равна: m = ω.mраствора = ω.ρ.1000, так как ω =
, масса вещества, выраженная через массовую долю равна: m = ω.mраствора = ω.ρ.1000, так как ω = 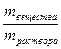 , а масса одного литра раствора равна: mраствора = ρ.1000, где ρ – плотность раствора в г/мл. Подставляем полученное выражение для массы вещества и получаем: СМ = ω. ρ.1000/M =
, а масса одного литра раствора равна: mраствора = ρ.1000, где ρ – плотность раствора в г/мл. Подставляем полученное выражение для массы вещества и получаем: СМ = ω. ρ.1000/M = 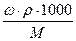 =
= 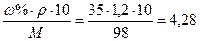 моль/л
моль/л
Cн. = Z.CM =8,56 моль.экв./л
14. Для растворения 5,2 г некоторого металла потребовалось 14,7 г серной кислоты (считая на чистое вещество). Определите эквивалентную массу металла и объем выделившегося водорода.
Закон эквивалентов для масс реагирующих веществ: массы реагирующих и образующихся относятся друг к другу, как их эквивалентные массы
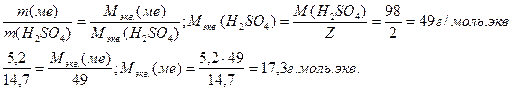
Для расчета объема выделившегося водорода используем формулу включающую эквивалентные объемы газов при нормальных условиях вместо эквивалентных масс
Количество моль.экв. водорода равно химическому количеству эквивалентов серной кислоты и металла. Объем выделившегося водорода равен произведениюхимического количества эквивалентов на объем моль.экв. водорода:
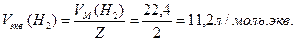
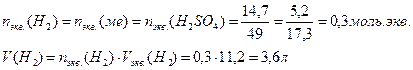
15. Водородные соединения элементов второго периода.
Гидриды металлов - основания кислоты
Li+H-, Be+2H2-, B+3H-3, CH4, N-3H3+, H2+O-2, H+F-
Li+H- + N-H3+ = LiNH2 + H2 Li+H- + H2+O-2= LiOH + H2 Na0 + N-H3+ = NaNH2 + H2
N-3H3+ + H+ = [NH4]+ H2+O-2+ H+ = [H3O]+
Гидриды металлов могут оторвать протон даже связанный с углеродом. Например, от α-положения к карбонильной группе:
СН3-СО-СН3 + Li+H- = Li+ -СН2-СО-СН3 + Н2
Комплексные гидриды используются как восстановители органических соединений:
Li+H- +Al+3H3- = Li+[AlH4]- алюмогидрид лития
B+3H-3 + Na+H- = Na+[BH4]- натрия борогидрид
СН3-СО-СН3 + Na+[BH4]-→ СН3-СНОН-СН3
15. Напишите уравнения реакции диссоциации комплексного соединения K2[CoCl4]
в растворе. Напишите выражение для константы нестойкости этого комплекса
первичная диссоциация – необратимый распад на внутреннюю и внешнюю сферу: K2[CoCl4] → 2K++[CoCl4]2-
вторичная диссоциация – обратимый распад внутренней сферы. Каждая ступень характеризуется своей константой нестойкости:
[CoCl4]2- ↔ [CoCl3]-+ Cl- 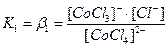
[CoCl3]- ↔ [CoCl2]0 + Cl- 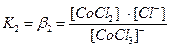
[CoCl2]0 ↔ [CoCl]+ + Cl- 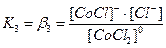
[CoCl]+ ↔ Co2+ + Cl- 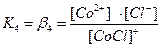
Общие (суммарные) константы нестойкости комплексов характеризуют их полную диссоциацию на комплексообразователь и лиганды и равны произведению ступенчатых констант:
[CoCl4]2- ↔ Co2+ + 4Cl- полная вторичная диссоциация
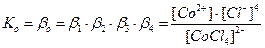
16. Определите реакцию среды в водных растворах следующих солей :
К3PO4 CuSO4 Ca(NO3)2
Подтвердите свой вывод уравнениями соответствующих реакций гидролиза.
К3PO4 → 3К+ + PO4-3
PO4-3 + HOH ↔ HPO4-2 + OH- (основная среда)
CuSO4 → Cu+2 + SO4-2
Cu+2 + HOH ↔ (CuOH) + + H+ (кислая среда)
Ca(NO3)2 → Ca+2 + 2NO3- (нейтральная среда)
17. На какие ионы будут диссоциировать в водном растворе соли, имеющие состав
KAl(SO4)2 и K3AlF6 ? Напишите соответствующие уравнения диссоциации
Алюминий переходный металл и его трехзарядный катион является комплексообразователем:
KAl(SO4)2 → K+ + [Al(SO4)2]- (первичная диссоциация, SO42- - бидентатный лиганд, координационное число комплексообразователя равно 4)
[Al(SO4)2]-↔ Al+3 + 2SO4)2-2 (полная вторичная диссоциация)
K3AlF6 → 3K+ + [AlF6]-3 (первичная диссоциация, координационное число Al+3 – 6)
[AlF6]-3 ↔ Al+3 + 6F- (полная вторичная диссоциация)
18. Укажите, между молекулами каких соединений может образовываться водородная связь (схема образования связи):
SiH4, CH3OH , H2S , CH3COOH , HBr , NH3 , ВF3, HF , CH3Cl , H2O, СН3-СО-СН3
Между молекулами, содержищими Н-Х связь,где Х=N, О, F, Cl, Br, I и т.д., могут образоваться водородные связи, в частности, всех кислот, спиртов, аминов
SiH4, CH3OH , H2S , CH3COOH , HBr , NH3 , ВF3, HF , CH3Cl , H2O, СН3-СО-СН3
CH3OH , H2S , CH3COOH , HBr , NH3 , HF , H2O – могут
SiH4, ВF3, CH3Cl , СН3-СО-СН3 – не могут
19. Определите значение водородного показателя, рН, в растворе HCl с концентрацией 0,0001 моль/л и в растворе NaOH с концентрацией 0,001 моль/л
| рН Сильной кислоты HCl→ H+ + Cl- | pH = -lg[H+] = -lgСн, где Сн или Сэк., СN –нормальная концентрация кислоты. рН =-lg10-4 =4 |
| рН Сильного основания NaOH→Na+ + OH- | рОН = - lg[OH-] = - lgСo, где Сo или Сэк., СN – нормальная концентрация основания рН = 14 - рОН= 14 + lg[OH-] = 14 + lgСo = 14 -3 = 11 |
20. Определите заряд и координационное число иона-комплексообразователя в соединениях : Mg2[Fe(CN)6], Na2[Co(NH3)2(NO2)4], [Co(NH3)5(H2O)]Br3
CN- , (NH3)0, NO2- , (H2O)0
+2, 6 +2, 6 +3, 6
Mg2[Fe(CN)4 (NО2)2], Na2[Co(NH3)2(СN)4], [Co(NH3)5(H2O)]Br3
+4 +2 -4 -2 +2 +2 0 -4 +3 0 0 -3
Суммарный заряд всех ионов комплексного соединения равен нулю
21. Не производя вычисления, определите знак изменения энтропии в следующих реакциях:
3H2 (г) + N2(г) = 2NH3 (г)
NH4NO2 (кр) = N2 (г) + 2H2O(г)
Na2CO3(ж) + 2HCl (ж) = 2NaCl(ж) + H2O(ж) + CO2(г)
3H2 (г) + N2(г) = 2NH3 (г) ∆S<0
NH4NO2 (кр) = N2 (г) + 2H2O(г) ∆S>0
Na2CO3(ж) + 2HCl (ж) = 2NaCl(ж) + H2O(ж) + CO2(г) ∆S>0
22. Во сколько раз изменится скорость химической реакции (прямой)
2NO(газ) + O2(газ) = 2NO2(газ)
если уменьшить объем реакционного сосуда в 2 раза ?
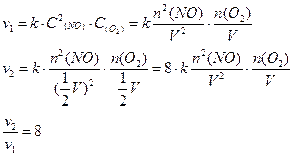
23. Укажите, какие из перечисленных ионов могут быть восстановителями :
SO4-2, NO2- , Cu2+ , Sn2+ , F- , IO4- , Al3+ , I- , Fe3+ , SO32-
SO4-2, NO2- , Cu2+ , Sn2+ , F- , JO4- , Al3+ , I- , Fe3+ , SO32-
SO4-2 (S+6), Cu2+ , F- , IO4- (I+7) , Al3+, Fe3+ - не могут
NO2- (N+3) , Sn2+ , I- , SO32- (S+4) – могут
24. Определите стандартное изменение энтальпии DrН0 реакции сгорания этана
2C2H6(г) + 7O2(г) = 4CO2(г) + 6H2O (г) и стандартную энтальпию сгорания
этана DflH0298 по известным энтальпиям образования:
DН0(CO2(г)) = -393,5 кДж\моль
DН0(H2O (г)) = -241,8 кДж\моль
DН0(CH4(г)) = -89,7 кДж\моль
Закон Гесса: DrH0298 = ∑vi · DfH0298,i - ∑vj ·DfH0298,j=
прод. исход.
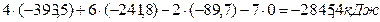
Стандартной энтальпией сгоранияназывается энтальпия реакции сгорания одного моля вещества в кислороде с образованием оксидов элементов, имеющих высшую степень окисления
C2H6(г) + 7/2O2(г) = 2CO2(г) + 3H2O (г)
DflH0298 =DrH0298/2 = -2845,4/2 = -1422,7 кДж/моль
25. Температурный коэффициент скорости химической реакции равен 3. Во сколько раз возрастет скорость реакции при повышении температуры от 600 С до 900 С ?
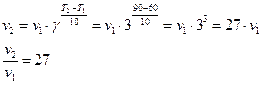
26. Расставить коэффициенты методом полуреакций и на основании величин стандартных электродных потенциалов (таблица), укажите, какие из приведенных реакций могут самопроизвольно протекать в кислом водном растворе:
1) MnO4- + Cl- + H+ ↔ MnO2 + Cl2 + H2O
2) MnO4- + Br-+ H+ ↔ MnO2 + Br2 + H2O
3) MnO4- +F- + H+ ↔ MnO2 + F2 + H2O
2MnO4- + 6Cl- + 8H+ ↔ 2MnO2 + 3Cl2 + 4H2O может
MnO4- + 4H+ + 3e- ↔ MnO2 + 2H2O E0= 1,70 B
2Cl- - 2e- ↔ Cl2 E0= 1,36 B
2MnO4- + 6Br-+ 8H+ ↔ 2MnO2 + 3Br2 + 4H2O может
MnO4- + 4H+ + 3e- ↔ MnO2 + 2H2O E0= 1,70 B
2Br- - 2e- ↔ Br2 E0= 1,07 B
2MnO4- +6F- + 8H+ ↔ 2MnO2 + 3F2 + 4H2O не может
MnO4- + 4H+ + 3e- ↔ MnO2 + 2H2O E0= 1,70 B
2F- - 2e- ↔ F2 E0= 2,87 B
27. В закрытом сосуде протекает обратимая химическая реакция :
2NO (газ) + O2 ↔ 2NO2(газ)
Начальные концентрации введенных в сосуд веществ составили :
[NO]=10 моль/л
[O2]=12,5 моль/л .
Равновесие наступило после того, как было израсходовано 50% оксида азота (II), NO. Определите равновесные концентрации NO, NO2 , O2 ; вычислите константу равновесия
5 2,5 израсходовалось
2NO (газ) + O2 ↔ 2NO2(газ)
5 10 5 концентрации в равновесии
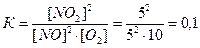
28. Сколько грамм 10% соляной кислоты необходимо взять, чтобы получить 250 мл 0,1 н раствора? Чему равна молярная концентрация этого раствора?
ω% = 10%, ω=0,1; Vраствора = 250 мл = 0,25 л
СМ = 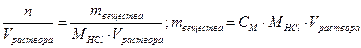 .
.
ω = 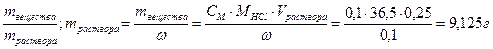
CН = Z∙CM; СМ = Сн/ Z = 0,05 моль/л
29. Какой объем грамм 50%-ной серной кислоты (плотность ρ =1,4 г/мл) надо взять, чтобы приготовить 2 л 0,1 н раствора этой кислоты? Чему равна молярная концентрация этого раствора?
ω% = 50%, ω=0,5; Vраствора = 2000 мл = 2 л
СМ = 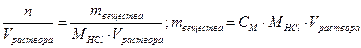 .
.
 ω =
ω = 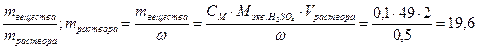 г
г
V2раствора= 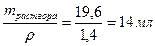
CН = Z∙CM; СМ = Сн/ Z = 0,05 моль/л
Содержание
РАСТВОРЫ
Дисперсные системы
