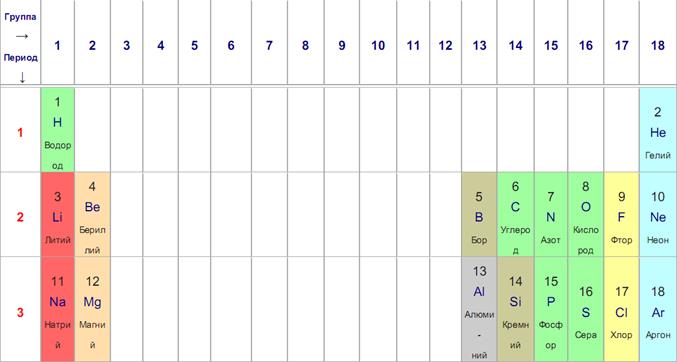
Периодический закон Д. И. Менделеева
• Свойства химических элементов, а также формы и свойства образуемых ими простых веществ и соединений находятся в периодической зависимости от величины зарядов ядер их атомов
• Свойства элементов определяются периодически повторяющимися однотипнами электронными конфигурациями их атомов.
• Электронные аналоги – элементы, атомы которых имеют подобные электронные конфигурации валентных электронов: ns1,ns2, ns2(n-1)d1, ns2(n-1)d2…. Это элементы, находящиеся в одной группе и подгруппе.
• Например,седьмая группа, главная подгруппа: F, Cl, Br, I. Электронная конфигурация – 3s2p5, 4s2p5, 5s2p5, 6s2p5. Образуют однотипные кослоты: HF, HCl, HBr, HI; HClO4, HBrO4, HlO4; HClO3, HBrO3, HlO3; HClO, HBrO, HlO;
• седьмая группа, побочная подгруппа: Mn, Tc, Re. Электронная конфигурация – 3d5 4s2p5, 4d55s2p5, 5d56s2p5. Образуют однотипные кослоты: HMnO4, HTcO4, HReO4
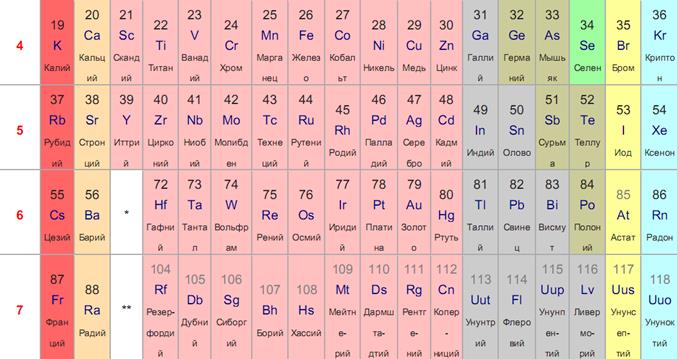
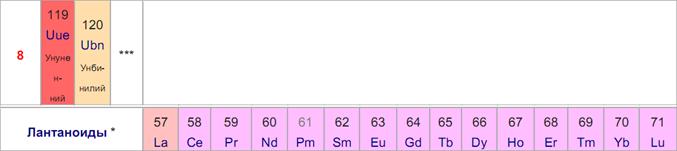
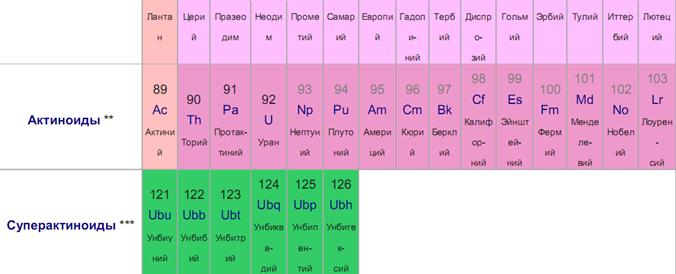
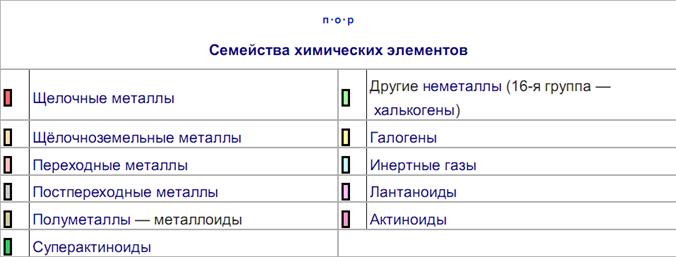
Периодическая система химических элементов Д. И. Менделеева
Взаимодействие металлов с кислотами
Соляная HCl. Взаимодействует (растворяет) только с металлами, стоящими в электрохимическом ряду напряжений до водорода с выделением газообразного водорода (Н2):
Mg + 2HCl → MgCl2 + H2
Азотная HNO3. Азотная кислота является окислителем. Чем сильнее разбавлена кислота и активнее металл, тем глубже восстановление азота. В ходе реакций окисления никогда не выделяется водород (Н2):
Cu + HNO3 (конц.) → Cu(NO3)2 + NO2 + H2O +4
Cu + HNO3 (разб.) → Cu(NO3)2 + NO + H2O +2
Mg + HNO3 (разб.) → Mg(NO3)2 + N2O + H2O +1
Ni + HNO3 (разб.) → Ni(NO3)2 + NO + H2O +2
Zn + HNO3 (разб.) → Zn(NO3)2 + NH4NO3 + H2O -3
Царская водка – смесь одной части азотной и трех частей соляной кислоты:
3HCl + HNO3 → Cl2 + NOCl2 + 2H2O
NOCl2 → Cl2 + NO
Au + 3HCl + HNO3 → AuCl3 + NO + 2H2O
Pt +12HCl + 4HNO3 → 3PtCl4 + 4NO + 8H2O
Cерная H2SO4. Разбавленная взаимодействует (растворяет) только с металлами, стоящими в электрохимическом ряду напряжений до водорода с выделением газообразного водорода (Н2):
Zn + H2SO4 (разб.) → ZnSO4 + H2
Концентрированная при взаимодействии с металлами (кроме золота и платины) может восстанавливаться до SO2, S, H2S. Может окислять углерод, фосфор и серу:
Cu + 2H2SO4 (конц.) → CuSO4 + SO2 + 2H2O +4
2Ag + 2H2SO4 (конц.) → Ag2SO4 + SO2 + 2H2O +4
8Na + 5H2SO4 (конц.) → 4Na2SO4 + H2S + 4H2O -2
C + 2H2SO4 (конц.) → CO2 + 2SO2 + 2H2O
S + 2H2SO4 (конц.) → 3SO2 + 2H2O
2P + 5H2SO4 (конц.) → 2H3PO4 + 5SO2 + 2H2O
ЛИТЕРАТУРА
1. Н.В. Глинка. Общая химия - М: Интеграл-Пресс, 2011.
2. А.В. Суворов, А.Б. Никольский. Общая химия - М: Химиздат, 2001.
3. Н.С. Ахметов. Общая и неорганическая химия - М.: Высшая школа, 2009.
4. Н.С. Ахметов. Актуальные вопросы курса неорганической химии - М.: Просвящение, 1991.
5. H.В. Коровин. Общая химия. – М.: Высшая школа, 2010.
6. Я.А. Угай. Общая химия и неорганическая - М: Высшая школа, 2007.
7. А.П. Гаршин. Неорганическая химия в схемах. – Спб: Лань, 2000.
8. М. Фримантл. Химия в действии. (в 2-х частях). – М.: Мир, 1998.
9. М.Х. Карапетьянц. Общая и неорганическая химия. – М.: Химия, 2000.
10. А.Р. Цыганов. Лабораторный практикум по общей химии: Учебное пособие. – Мн.: Ураджай, 1998.
11. А.Р. Цыганов. Общая химия. Биофизическая химия. – Мн.: Ураджай, 1998.
12. С.А. Пузаков. Химия. – М.: Медицина, 1995.
13. Е.В. Барковский, С.В. Ткачев. Общая химия. Курс лекций. - Мн.: БГМУ, 2009.
14. П.А. Галушков. Теоретические основы химии. Ч.1. – Новополоцк: ПГУ, 2010.
15. К.Е. Хаускрофт, Э. Констэбл. Современный курс общей химии. В 2-х томах. М.: Мир, 2009.
16. Н.Ю. Келина, Н.В. Безручко. Общая и неорганическая химия в таблицах и схемах. – Ростов-на-Дону: Феникс, 2008.
17. Г.Э. Атрахимович, О.В. Ачинович, С.В. Барченко, О.П. Болбас, А.Р. Козел. Козюлевич. Общая химия. Учебно-тренировочные материалы. – Минск: БГМУ, 2009.
18. П.А. Галушков. Неорганическая химия. – Новополоцк: ПГУ, 2009.
19. В.А. Ашуйко, Л.Н. Новикова, С. Е. Орехова. Химия комплексных соединений. – Минск, 2010.
20. И.Е. Шиманович, В.А. Красицкий, А.Н. Богатиков, В.Н. Хвалюк, А.А. Рагойша. Общая и неорганическая химия. Задачи, вопросы, упражнения. – Мн.: БГУ, 2010. – 231с.
21. И.Е. Шиманович, В.А. Красицкий, А.Н. Богатиков, В.Н. Хвалюк, А.А. Рагойша. Учебное руководство по курсу “Общая и неорганическая химия” – Мн.: РИВШ, 2009. – 130с.
22. И.Б. Бутылина, С.И. Полушкина. Химия. Сборник задач. Мн.: БГАТУ, 2011.
23. И.М. Жарский, В.В. Белоусова, И.В. Бычек, Л.Н. Новикова, В.Г. Матыс. Теоретические основы химии. Минск: БГТУ, 2011. – 179 с.
24. К.Е. Хаускрофт, Э. Констэбл. Современный курс общей химии. Задачник. М.: Мир, 2009. – 250 с.
25. Г.П. Жмурко, Е.Ф. Казакова, В.Н. Кузнецов, В.А. Яценко. Общая химия. М.:.Академия, 2011. – 512 с.
26. В.А. Попков, Ю.А. Ершов, А.С. Берлянд. Общая химия. Биофизическая химия. Химия биогенных элементов. М.: Юрайт, 2011. – 560с.
27. В.В. Болтромеюк. Общая химия. Мн.: Высшая школа, 1912. – 624с.
28. И.А. Пресс. Основы общей химии для самостоятельного изучения. СПб: Лань, 2012. – 496с.
29. Н.Н. Павлов. Общая и неорганическая химия. СПб: Лань, 2011. – 496с.
30. В.В. Еремин, А.Я. Борщевский. Основы общей и физической химии. Долгопрудный: Изд. Дом «Интеллект», 2012. – 848с.
31. Л.А. Мечковский, А.В. Блохин. Химическая термодинамика. В 2 Ч. Ч.1. Минск: БГУ, 2012. – 144с.
32. Е.В. Барковский, С.В. Ткачев, Л.Г. Петрушенко. Общая химия./Мн.: Вышэйшая школа, 2013. – 639 С.
33. В.И. Елфимов. Основы общей химии: Учеб. Пособие. – 2-е изд. – М.: ИНФРА-М, 2015. – 256с.
34. О.С. Зайцев. Химия.Изд. М.: Юрайт, 2015 – 470 с.
ПРИЛОЖЕНИЕ
Константы диссоциации кислот в водном растворе при 250 С.
| Кислота | К1 | К2 |
| HI | 1·1011 | |
| HBr | 1·109 | |
| HCl | 1·107 | |
| H2SO4 | 1·103 | 1,2·10-2 |
| HNO3 | 4,36·10 | |
| HClO4 | 3,8·10 | |
| CCl3COOH | 2,2·10-2 | |
| H2SO3 | 1,58·10-2 | 6,31·10-8 |
| H3PO4 | 7,52·10-3 | 6,31·10-8 |
| HF | 6,61·10-4 | |
| HNO2 | 4·10-4 | |
| HCOOH | 1,77·10-4 | |
| CH3COOH | 1,754·10-5 | |
| H2CO3 | 4,45·10-7 | 4,69·10-11 |
| H2S | 6·10-8 | 1·10-14 |
| HClO | 5,01·10-8 | |
| HCN | 7,9·10-10 | |
| H4SiO4 | 1,6·10-10 | 1,9·10-12 |
| C6H5OH | 1,0·10-10 | |
| H2O | 1,8·10-16 |
Константы диссоциации оснований в водном растворе при 250 С.
| Основание | К1 | К2 |
| KOH | 2,9 | |
| NaOH | 1,5 | |
| LiOH | 0,44 | |
| Ba(OH)2 | 0,23 | |
| Sr(OH)2 | 0,15 | |
| Ca(OH)2 | 4,3·10-2 | |
| Mg(OH)2 | 2,5·10-3 | |
| Fe(OH)2 | 1,2·10-2 | 5,5·10-8 |
| CH3NH2 | 4,2·10-4 | |
| NH3 | 1,7·10-5 | |
| Zn(OH)2 | 1,3·10-5 | 4,9·10-7 |
| Al(OH)3 | 8,3·10-9 | 2,1·10‑9 |
| C6H5NH2 | 3,8·10-10 | |
| Fe(OH)3 | 4,8·10-11 | 1,8·10‑11 |
