Закон сохранения массы веществ
Масса веществ, вступивших в химическую реакцию, равна массе веществ, образовавшихся в результате химической реакции.
На основании этого закона расставляют коэффициенты в уравнениях химических реакций.
С законом сохранения массы неразрывно связан и закон сохранения энергии, т.к. в их основе лежит общий принцип сохранения материи и движения.
2) Закон сохранения энергии
Энергия не возникает из ничего и не исчезает бесследно, а отдельные ее виды могут взаимно превращаться друг в друга в эквивалентных соотношениях.
3) Закон эквивалентов
Вещества взаимодействуют между собой в количествах, пропорциональных их химическим эквивалентам.
Для реакции:
аА + вВ = сС + dD
протекающей в растворе, закон эквивалентов можно записать следующим образом:
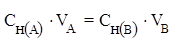
где 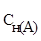 и
и 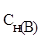 - молярные концентрации эквивалентов (нормальности) реагирующих растворов, моль/л;
- молярные концентрации эквивалентов (нормальности) реагирующих растворов, моль/л;
VA и VB - объёмы реагирующих растворов, л или мл.
Например, для реакции нейтрализации:
3KOH + H3PO4 = K3PO4 + 3H2O
закон эквивалентов можно записать:
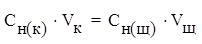
где Сн (к) – молярная концентрация эквивалентов кислоты,
Сн(щ) – молярная концентрация эквивалентов щелочи,
Vк – объем кислоты,
Vщ – объем щелочи.
4) Закон Авогадро
Это один из основных законов естествознания.
В равных объемах любых газов при одинаковых физических условиях содержится одинаковое число частиц (молекул или атомов, если простое вещество не образует молекул).
Очень важно следствие из закона Авогадро:
При одинаковых физических условиях один моль любого газа имеет одинаковый объем. В частности, при нормальных условиях (н.у.) 1 моль любого газа занимает объем, равный 22,4 литра. В таком объеме содержится 6,02∙1023 частиц (число Авогадро).
Таблица 2.1
Характеристика физических условий
| Физические условия | Температура | Давление | ||
| Система СИ | Внесистемные единицы | Система СИ | Внесистемные единицы | |
| Нормальные условия (н.у.) | 273,15К | 00 С | 101325 Па | 1 атм |
| Стандартные условия (ст.у.) | 298,15К | 250 С | 101325 Па | 1 атм |
| Комнатные условия | 293,15К | 200 С | 101325 Па | 1 атм |
Растворы
Дисперсная система – это система, состоящая из двух и более веществ, в которой одно или несколько веществ размельчены и распределены в другом веществе.
Распределенное вещество называется дисперсной фазой.
Вещество, в котором распределена дисперсная фаза, называется дисперсной средой.
Дисперсная система в зависимости от размеров частиц дисперсной фазы может быть гомогенной (однородной) и гетерогенной.
В зависимости от размера частиц гетерогенные дисперсные системы делятся на 3 группы:
1) коллоидные системы (или высокодисперсные, или золи), у которых размер частиц 1 – 500 нм (1 нм = 10-9 м),
2) грубодисперсные системы (взвеси), размер частиц которых 500 – 1000 нм,
3) механические смеси, размер частиц которых больше 1000 нм, но меньше 10000 нм (0,01 мм).
Дисперсные системы классифицируются по агрегатным состояниям
дисперсной фазы и дисперсной среды. Примеры приведены в таблице 2.2.
Таблица 2.2
Классификация дисперсных систем
| Агрегатное состояние дисперсной среды | Агрегатное состояние дисперсной фазы | ||
| газовое | жидкое | твердое | |
| Газовое | - | аэрозоль | аэрозоль |
| Жидкое | пена | эмульсия | суспензия |
| Твердое | твердая пена | твердая эмульсия, гель (желе) | твердые включения в твердых телах |
Гомогенные дисперсные системы называются истинными растворами.
Степень измельчения дисперсной фазы в истинном растворе молекулярная или ионная, т.е. размеры частиц не превышают размеров отдельных молекул и ионов (меньше 1 нм).
Составные части истинных растворов нельзя разделить простыми механическими способами: отстаиванием, фильтрованием и т.п.
Раствор – это однородная система, состоящая из двух и более компонентов.
Условно один из компонентов раствора называется растворителем, другие – растворенными веществами.
Одним из самых распространенных растворителей является вода H2O.
Масса раствора связана с объемом раствора соотношением:
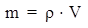
где ρ – плотность раствора, измеряется в г/мл (система СГС) или в кг/м3 (система СИ).
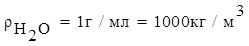
1.4 Способы выражения концентрации растворов
Содержание растворенного вещества в определенном количестве раствора или растворителя называется концентрацией.
1) процентная концентрация С% –масса растворенного вещества, содержащегося в 100 г раствора.
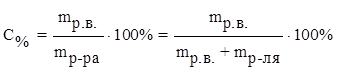
где mр.в. – масса растворенного вещества (г),
mр-ра – масса раствора (г),
mр-ля – масса растворителя.
2) молярная концентрация (молярность) СМ– число молей растворенного вещества, содержащихся в 1 литре раствора.
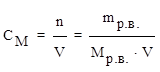 ;
;
где n – количество вещества (моль),
V – объем (л),
М (р.в.) – молярная масса растворенного вещества (г/моль).
[СМ] = моль/л
3) молярная концентрация эквивалента (нормальность)
СН – число молей эквивалента растворенного вещества, содержащихся в 1 литре раствора.
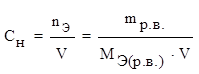
где nЭ – количество вещества эквивалента (моль),
V – объем (л),
МЭ (р.в.) – молярная масса эквивалента растворенного вещества (г/моль).
[СН] = моль/л
4) моляльная концентрация (моляльность) Сm –число молей растворенного вещества, приходящихся на 1 кг растворителя.
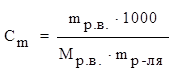
где mр-ля – масса растворителя, выраженная в граммах.
[Сm] = моль/кг
РЕШЕНИЕ ТИПОВЫХ ЗАДАЧ
