Стандартная свободная энергия Гиббса (изобарно-изотермический потенциал), как критерий самопроизвольности протекания процессов
Определите, возможен ли процесс при стандартных условиях, используя: а) значения стандартной свободной энергии Гиббса образования веществ; б) энтальпийный и энтропийный факторы реакции:
01 – AgF(тв) + 0,5Cl2(г) = AgCl(тв) + 0,5F2(г)
02 – Be(тв) + H2O(ж) = BeO(тв) + H2(г)
03 – B2O3(тв) + 3CO(г) = 2B(тв) + 3CO2(г)
04 – BaO2(тв) + CO(г) = BaCO3(тв)
05 – BaO2(тв) = BaO(тв) + 0,5O2(г)
06 – BaCO3(тв) = BaO(тв) + CO2(г)
07 – BaO(тв) + H2(г) = Ba(тв) + H2O(ж)
08 – BaO(тв) + C(ГРАФИТ) = Ba(тв) + CO(г)
09 – BaO(тв) + CO(г) = Ba(тв) + CO2(г)
10 – B2O3(тв) + 3H2(г) = 2B(тв) + 3H2O(ж)
11 – 2C(графит) + 4Al(тв) = Al4C3(тв)
12 – 2B(тв) + 3H2(г) = B2H6(г)
13 – 2HI(г) + 0,5O2(г) = H2O(ж) + I2(тв)
14 – 2HBr(г) + 0,5O2(г) = H2O(ж) + Br2(ж)
15 – 2H2(г) + Si(тв) = SiН4(г)
16 – P(тв) + 1,5H2(г) = PH3(г)
17 – CaCO3(тв) = CaO(тв) + CO2(г)
18 – 2HCl(г) + O3(г) = Cl2(г) + H2O(ж) + O2(г)
19 – 2HF(г) + 0,5O2(г) = H2O(ж) + F2(г)
20 – H2O(ж) + O3(г) = H2O2(ж) + O2(г)
21 – 0,5Cl2(г) + O2(г) = ClO2(г)
22 – CS2(ж) + 3O2(г) = CO2(г) + 2SO2(г)
23 – CO2(г) + 2H2S(г) = CS2(г) + 2H2O(ж)
24 – COS(г) + H2O(ж) = CO2(г) + H2S(г)
25 – CO2(г) + 2HCl(г) = COCl2(г) + H2O(ж)
26 – BaO(тв) + SO3(г) = BaSO4(тв)
27 – CH4(г) + 3CO2(г) = 4CO(г) + 2H2O(ж)
28 – Mg(тв) + CO2(г) = MgO(тв) + CO(г)
29 – MgCO3(тв) = MgO(тв) + CO2(г)
30 – CO(г) + S(г) = COS(г).
4.6. Вычислите изменение свободной энергии Гиббса, DG0 (кДж), следующих реакций, протекающих при указанной температуре (зависимостьюD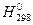 иD
иD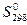 от температуры пренебречь), и определите возможность осуществления в указанных условиях следующих реакций:
от температуры пренебречь), и определите возможность осуществления в указанных условиях следующих реакций:
| Вариант | Уравнение реакции | Т, К |
| 1. | CaCO3(тв) = CaO(тв) + CO2(г) | |
| 2. | CH4(г) + 3CO2(г) = 4CO(г) + 2H2O(г) | |
| 3. | Ag2O(тв) + H2(г) = 2Ag(тв) + H2О(г) | |
| 4. | AsH3(г) + 3Cl2(г) = AsCl3(г) + 3HCl(г) | |
| 5. | PH3(г) = P(г) + 1,5H2(г) | |
| 6. | MgO(тв) + CO(г) = Mg(тв) + CO2(г) | |
| 7. | CO(г) + Cl2(г) = COCl2(г) | |
| 8. | Cl2O(г) = Cl2(г) + 1,5O2(г) | |
| 9. | 2SO3(г) = 2SO2(г) + O2(г) | |
| 10. | H2S(г) = H2(г) + S(г) | |
| 11. | BaCO3(тв) = BaO(тв) + CO2(г) | |
| 12. | 2HI(г) = H2(г) + I2(г) | |
| 13. | 2HBr(г) = H2(г) + Br2(г) | |
| 14. | 2HCl(г) = H2(г) + Cl2(г) | |
| 15. | 2HF(г) = H2(г) + F2(г) | |
| 16. | FeO(тв) + CO(г) = Fe(тв) + CO2(г) | |
| 17. | H2O(г) + Fe(тв) = H2(г) + FeO(тв) | |
| 18. | H2(г) + S(г) = H2S(г) | |
| 19. | C(тв) + CO2(г) = 2CO(г) | |
| 20. | 2NO2(г) = O2(г) + 2NO(г) | |
| 21. | 0,5N2(г) + 1,5H2(г) = NH3(г) | |
| 22. | Fe2O3(тв) + 3H2(г) = 3Fe(тв) + 3H2O(г) | |
| 23. | Fe3O4(тв) + 4CO(г) = 3Fe(тв) + 4CO2(г) | |
| 24. | PH3(г) = P(г) + 1,5H2(г) | |
| 25. | PbSO4(тв) = PbO(тв) + SO3(г) | |
| 26. | Fe2O3(тв) + 3CO(г) = 2Fe(тв) + 3CO2(г) | |
| 27. | MgCO3(тв) = MgO(тв) + CO2(г) | |
| 28. | 2HI(г) + 0,5O2(г) = I2(г) + H2O(г) | |
| 29. | 2HBr(г) + 0,5O2(г) = Br2(г) + H2O(г) | |
| 30. | 2HCl(г) + 0,5O2(г) = Cl2(г) + H2O(г) |
ХИМИЧЕСКая кинетика
5.1. Дайте определение понятию «скорость химической реакции». Как выражается скорость химической реакции? От каких факторов она зависит? Сформулируйте закон действующих масс. Какой физический смысл имеет константа скорости реакции? От каких факторов зависит эта величина?
Напишите математическое выражение закона действующих масс для реакции:
| 01 – 2A(г) + B(ж) = A2B(г) 03 – H2(г) + I2(г) = 2HI(г) 05 – O2(г) + 2CO(г) = 2CO2(г) 07 – 2NO(г) + O2(г) = 2NO2(г) 09 – 2F2(г) + O2(г) = 2OF2(г) 11 – 3H2(г) + N2(г) = 2NH3(г) 13 – 2HBr(г) = H2(г) + Br2(г) 15 – CO(г) + Cl2(г) = COCl2(г) 17 – C2H4(г) + H2(г) = C2H6(г) 19 – 2Cl(г) = Cl2(г) 21 - 2SO2(г) + O2(г) = 2SO3(г) 23 – 2N2(г) + O2(г) = 2N2O(г) 25–CO(г)+H2O(г) = CO2(г)+ H2(г) 27 – 2HI(г) = H2(г) + I2(г) 29 – 2SO3(г) = 2SO2(г) + O2(г) | 02 – CaO(тв) + CO2(г) = CaCO3(тв) 04 – 3Fe(тв) + 4H2O(г) = F3O4(тв) + 4H2(г) 06 – H2(г) + S(тв) = H2S(г) 08 – CO2(г) + C(тв) = 2CO(г) 10 – Fe3O4(тв) + H2(г) = 3FeO(тв) + H2O(г) 12 – C(тв) + O2(г) = CO2(г) 14 – 2Al(тв) + 3Cl2(г) = 2AlCl3(тв) 16 – 2S(тв) + 3O2(г) = 2SO3(г) 18 – Fe3O4(тв) + 4CO(г) = 3Fe(тв) + 4CO2(г) 20 – 4Al(тв) + 3O2(г) = 2Al2O3(тв) 22 – A(тв) + 2B(ж) = AB2(ж) 24 – 2NO(г) + Cl2(г) = 2NOCl(г) 26 – C(тв) + H2O(г) = CO(г) + H2(г) 28 – C2H4(г) + 3O2(г) = 2CO2(г) + 2H2O(г) 30 – A(г) + 3B(г) = AB3(г) |
5.2. Зависимость скорости химической реакции от концентрации реагирующих веществ. Как зависит скорость химической реакции от концентрации реагирующих веществ?
а) Как изменится (во сколько раз) скорость реакции, если концентрацию первого реагирующего вещества увеличить в три раза:
| 01 – 2A2(г) + B2(г) = 2A2B(г) 03 – C2H2(г) + H2(г) = C2H4(г) | 02 – 2NO(г) + Cl2(г) = 2NOCl(г) 04 – 4HCl(г) + O2(г) = 2Cl2(г) + 2H2O(г) |
Ответ обоснуйте, проведя соответствующие вычисления.
б) Как изменится (во сколько раз) скорость реакции, если концентрацию второго реагирующего вещества увеличить в три раза:
| 05 – A2(г) + 3B(г) = AB3(г) 07 – CO(г) + Cl2(г) = СOCl2(г) | 06 – O2(г) + 2F2(г) = 2OF2(г) 08 – 2N2(г) + O2(г) = 2N2O(г) |
Ответ обоснуйте, проведя соответствующие вычисления.
в) Как изменится (во сколько раз) скорость реакции, если концентрации реагирующих веществ увеличить в два раза:
| 09 – 2A(г) + 3B(г) = A2B3 11 – 2NO(г) + O2(г) = 2N2O(г) 13 – H2(г) + I2(г) = 2HI(г) | 10 – C2H4(г) + 3O2(г) = 2CO2(г) + 2H2O(г) 12 – C2H2(г) + H2(г) = C2H4(г) 14 – 2SO2(г) + O2(г) = 2SO3(г) |
Ответ обоснуйте, проведя соответствующие вычисления.
г) Как изменится (во сколько раз) скорость реакции при увеличении давления в два раза:
| 15 – 2NO(г) + O2(г) = 2NO2(г) 17 – N2(г) + O2(г) = 2NO(г) 19 – CO(г) + Cl2(г) = COCl2(г) | 16 – 2S(тв) + 3O2(г) = 2SO3(г) 18 – C(тв) + O2(г) = CO2(г) 20 – A(тв) + 2B(г) = AB2(г) |
Ответ обоснуйте, проведя соответствующие вычисления
д) Как изменится (во сколько раз) скорость реакции при уменьшении давления в 4 раза:
| 21 – H2(г) + Cl2(г) = 2HCl(г) 23 – 2H2(г) + O2(г) = 2H2O(г) 25 – N2O4(г) = 2NO2(г) 27 – CO(г) + Cl2(г) = COCl2(г) 29 – 2A(г) + B(ж) = A2B(ж) | 22 – 2Al(тв) + 3Cl2(г) = 2AlCl3(тв) 24 – 2C(тв) + O2(г) = 2CO(г) 26 – 3A(г) + 2B(ж) = A3B2(г) 28 – H2(г) + S(тв) = H2S(г) 30 – 2CO(г) + O2(г) = 2CO2(г) |
Ответ обоснуйте, проведя соответствующие вычисления.
Зависимость скорости химической реакции от температуры процесса. Как влияет температура на скорость реакции? Сформулируйте правило Вант-Гоффа. Что называется температурным коэффициентом скорости реакции?
а) Рассчитайте, во сколько раз увеличится скорость химической реакции при повышении температуры на 20 0 С, если:
01 - g = 2,0; 02 - g = 3,2; 03 - g = 2,5
б) Рассчитайте, на сколько градусов следует повысить температуру системы, чтобы скорость протекающей в ней реакции возросла в 16 раз, если:
04 - g = 2,0; 05 - g = 4,0; 06 - g = 3,5.
в) Рассчитайте, на сколько градусов следует повысить температуру системы, чтобы скорость протекающей в ней реакции, для которой g = 2,0, возросла в:
07 – 128 раз; 08 – 32 раза; 09 – 4 раза.
г) Рассчитайте, чему равен температурный коэффициент скорости реакции, если при увеличении температуры на 300 скорость реакции возросла в:
10 – 27 раз; 11 – 8 раз; 12 – 64 раза.
д) При 00 С скорость реакции равна 1,0 моль/(л × мин.), g = 2,0. Рассчитайте, чему равна скорость этой реакции при:
13 – 50 0С; 14 – 30 0С; 15 – 70 0С.
е) При 1000С скорость реакции равна 1,0 моль/ (л × мин.), g = 2,0. Рассчитайте, во сколько раз медленнее протекает эта реакция при:
16 – 40 0С; 17 – 80 0С; 18 – 50 0С.
ж) При 100 0С реакция, для которой g = 2,0, заканчивается за 20 с. Рассчитайте, через какое время закончится эта реакция при:
19 – 50 0С; 20 – 80 0С; 21 – 120 0С.
з) При 0 0С реакция, для которой g = 2,0, заканчивается за 120 с. Рассчитайте, при какой температуре закончится эта реакция за:
22 – 15 с; 23 – 30 с; 24 – 60 с.
и) Во сколько раз увеличится скорость химической реакции при повышении температуры на 500С, если:
25 – g = 2,2; 26 – g = 3,3; 27 – g = 4,1.
к) Рассчитайте, чему равен температурный коэффициент скорости реакции, если при увеличении температуры на 400С скорость реакции возросла в:
28 – 32 раза; 29 – 81 раз; 30 – 256 раз.
Кинетические расчеты
а) В процессе реакции концентрация первого реагирующего вещества уменьшилась на 0,01 моль/л. Как при этом изменится концентрация второго вещества, если реакция идет по уравнению:
| 01 – СO(г) + Cl2(г) = COCl2(г) 03 – 2NO(г) + O2(г) = 2NO2(г) 05 – 3H2(г) + N2(г) = 2NH3(г) | 02 – O2(г) + 2SO2(г) = 2SO3(г) 04 – 2CO(г) + O2(г) = 2CO2(г) 06 – 2A(г) + B(г) = A2B(г) |
б) В процессе реакции концентрация второго реагирующего вещества уменьшилась на 0,1 моль/л. Как при этом изменилась концентрация первого вещества, если реакция идет по уравнению:
| 07 – 2NO(г) + Cl2(г) = 2NOCl(г) 09 – O2(г) + 2NO(г) = 2NO2(г) 11 – 2H2(г) + O2(г) = 2H2O(г) | 08 – H2(г) + Cl2(г) = 2HCl(г) 10 – C2H2(г) + H2(г) = C2H4(г) 12 – 3A(г) + B(г) = A3B(г) |
в) В начальный момент в гомогенной системе концентрация первого реагирующего вещества была 1,5 моль/л, второго – 2,0 моль/л. Чему равны эти концентрации в момент достижения концентрации продукта реакции 0,5 моль/л:
| 13 – O2(г) + 2H2(г) = 2H2O(г) 15 – 2NO(г) + Cl2(г) = 2NOCl(г) 17 – A(г) + 3B(г) = AB3(г) | 14 – 2NO(г) + O2(г) = 2NO2(г) 16 – N2(г) + O2(г) = 2NO(г) 18 – CO(г) + Cl2(г) = COCl2(г) |
г) В некоторый момент концентрация первого реагирующего вещества была 0,1 моль/л, второго – 0,06 моль/л, а продукта реакции – 0,02 моль/л. Найдите концентрации всех веществ, в момент, когда концентрация первого вещества уменьшится на 0,02 моль/л для реакции:
| 19 – H2 (г) + I2(г) = 2HI(г) 21 – 2F2(г) + O2(г) = 2OF2(г) 23 – CO(г) + Cl2(г) = COCl2(г) | 20 – C2H2(г) + H2(г) = C2H4(г) 22 – O2(г) + 2NO(г) = 2NO2(г) 24 – A(г) + 3B(г) = AB3(г) |
д) В некоторый момент концентрация первого реагирующего вещества была 0,1 моль/л, второго – 0,2 моль/л, а продукта реакции – 0,05 моль/л. Вычислите концентрации всех веществ после того, как прореагировало 20 % первого вещества для реакции:
| 25 – O2(г) + 2CO(г) = 2CO2(г) 27 – CO(г) + Br2(г) = COBr2(г) 29 – N2(г) + 3H2(г) = 2NH3(г) | 26 – 2NO(г) + Cl2(г) = 2NOCl(г) 28 – C2H4(г) + Cl2(г) = C2H4Cl2(г) 30 – 3A(г) + B(г) = A3B(г) |
