И указать реакцию среды их водных растворов
|
 | РЕШЕНИЕ: а) Cr2(SO4)3 1. Под формулой соли написать формулы основания и кислоты, которыми образована соль, и подчеркнуть общий ион в формуле соли и слабого электролита. |

 Cr2(SO4)3 + 2Н2О <=> 2CrOHSO4 + H2SO4
Cr2(SO4)3 + 2Н2О <=> 2CrOHSO4 + H2SO4
|
|
слаб. сильн.


 Cr3+ + H+OH- <=> + , pH<7, среда
Cr3+ + H+OH- <=> + , pH<7, среда
кислая

2. Написать сокращенное ионно-молекулярное уравнение гидролиза с участием одного подчеркнутого иона и одной молекулы воды.
3. По полученному сокращенному ионно-молекулярному уравнению написать полное молекулярное уравнение. Для этого каждый ион в сокращенном ионно-молекулярном уравнении дополнить противоположно заряженными ионами соли, которые не участвовали в гидролизе. Написать формулы, образующихся веществ, используя правило электронейтральности их молекул, и расставить коэффициенты в молекулярном уравнении.
б) Na2S
Используя последовательность написания процесса гидролиза, изложенное в а) составляем сокращенное ионно-молекулярное и молекулярное уравнения гидролиза соли Na2S.
Na2S + H2O <=> NaHS + NaOH

 NaOH + H2S
NaOH + H2S
|
|

 S2- + H+OH- <=> + , pH > 7, среда
S2- + H+OH- <=> + , pH > 7, среда


 щелочная
щелочная
2. Написать ионно-молекулярное и молекулярное уравнения гидролиза хлорида алюминия (AlCl3). Как влияет на равновесие гидролиза прибавление к раствору следующих веществ:
а) бромоводородной кислоты (HBr);
б) гидроксида калия (KOH);
в) нитрата натрия (NaNO3)?
РЕШЕНИЕ
 AlCl3 + HOH <=> AlOHCl2 + HCl
AlCl3 + HOH <=> AlOHCl2 + HCl
 Al(OH)3 + HCl
Al(OH)3 + HCl
|
|

 Al3+ + H+OH- <=> +
Al3+ + H+OH- <=> +
 |
Как видно из сокращенного ионно-молекулярного уравнения, при гидролизе образуются катионы Н+, обуславливающие кислую среду раствора (рН<7).
Реакция гидролиза – процесс обратимый, поэтому равновесие гидролиза соли может смещаться при введении в раствор некоторых веществ (согласно правилу смещения равновесия по принципу Ле Шателье).
а) Если к раствору AlCl3 добавить бромоводородную кислоту HBr, то в результате её диссоциации (HBr = H+ + Br -) в растворе увеличится концентрация ионов H+, вследствие чего равновесие реакции гидролиза AlBr3 сместится в левую сторону (образование исходных веществ), т.е. гидролиз AlBr3 ослабевает.
|
 ←
← Al3+ + HOH <=> AlOH2+ +
HBr = Br - +
б) Если же к раствору AlCl3 добавить щелочь (КОН), то в результате ее диссоциации (КОН = К+ + ОН-) в растворе появляются ионы ОН-, которые с ионами Н+, полученными в реакции гидролиза, образуют молекулу слабого электролита (H2O), что приведет к уменьшению концентрации ионов Н+ и смещению равновесия реакции гидролиза в правую сторону, т.е. гидролиз AlCl3 усилится.
|
 →
→ Al3+ + HOH <=> AlOH2+ + → Н2О
КОН = К+ +
в) Нитрат натрия – сильный электролит, который не имеет общих ионов ни с AlCl3, ни с продуктами его гидролиза, и не связывает их в слабодиссоциирующие соединения, т.е. прибавление NaNO3 на равновесие гидролиза не влияет.
 Al3+ + HOH <=> AlOH2+ + H+
Al3+ + HOH <=> AlOH2+ + H+
NaNO3 = Na+ + NO3-
3. Указать, какая из двух солей хлорид цинка (ZnCl2) или хлорид меди (СuCl2), при равных концентрациях и температурах в большей степени подвергается гидролизу? Ответ мотивировать сравнением значений констант диссоциации слабых электролитов, образующих обе соли, по последней ступени. Составить ионно-молекулярные и молекулярные уравнения гидролиза этих солей.
Дано: 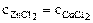 Т = const Т = const | РЕШЕНИЕ: |
| Указать, какя соль (ZnCl2 или CuCl2 ) в большей степени подвергается гидролизу. |

 ZnCl2 + H2O <=> ZnOHCl + HCl
ZnCl2 + H2O <=> ZnOHCl + HCl
Zn(OH)2 + HCl
|
|

 Zn2+ + HOH < = > + , рН < 7 - среда
Zn2+ + HOH < = > + , рН < 7 - среда
 кислая
кислая
CuCl2 + H2O < = > CuOHCl + HCl

 Cu(OH)2 + HCl
Cu(OH)2 + HCl
|
|
Cu2+ + HOH < = > + , рН < 7 - среда


 кислая
кислая
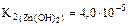 (табл. ).
(табл. ).
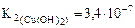 (табл.)
(табл.)
Т.к. 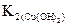 <
< 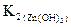 , то Cu(OH)2 – более слабый электролит, чем Zn(OH)2. Поскольку степень гидролиза соли h тем больше, чем слабее электролит, образующий эту соль (h ~ 1/K), CuCl2 в большей степени подвергается гидролизу.
, то Cu(OH)2 – более слабый электролит, чем Zn(OH)2. Поскольку степень гидролиза соли h тем больше, чем слабее электролит, образующий эту соль (h ~ 1/K), CuCl2 в большей степени подвергается гидролизу.
Ответ: При сравнении значений констант диссоциации по последней ступени слабых электролитов, образующих соли ZnCl2 и CuCl2, 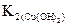 <
< 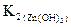 , поэтому CuCl2 в большей степени подвергается гидролизу, чем ZnCl2.
, поэтому CuCl2 в большей степени подвергается гидролизу, чем ZnCl2.
УРОВЕНЬ В
1. Составить ионно-молекулярное и молекулярное уравнения гидролиза карбоната калия (K2CO3). Вычислить константу, степень и рН гидролиза соли в 0,01М растворе.
| РЕШЕНИЕ: |
 |
K2CO3 + H2O <=> KHCO3 + KOH
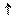 KOH + H2CO3
KOH + H2CO3
|
|

 СО32- + НОН <=> + , рН>7, среда
СО32- + НОН <=> + , рН>7, среда
 щелочная
щелочная
Kг = 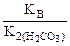 ,
,
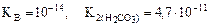 (табл.).
(табл.).
Kг = 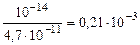 ,
,
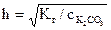 ,
, 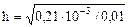 =0,14,
=0,14,
pH+ рОН=14.
Так как среда щелочная, то определяем 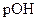 :
:
pОН= -1/2∙lgKг -1/2∙lg 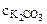 =
=
= 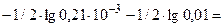 2,84
2,84
рН = 14-рОН, рН = 14-2,84=11,16,
Ответ: 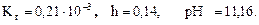
2. Рассчитать при температуре 300К константу, степень и рН гидролиза нитрат аммония (NH4NO3) в 1М растворе, используя значения термодинамических характеристик реакции гидролиза соли. Написать ионно-молекулярное и молекулярное уравнение гидролиза этой соли.
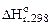 = 51,14 кДж;
= 51,14 кДж;
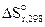 = - 4,67 Дж/К.
= - 4,67 Дж/К.
| РЕШЕНИЕ: |
NH4NO3 + H2O <=> NH4OH + HNO3
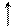
 NH4OH + HNO3
NH4OH + HNO3
|
NH4+ + HOH <=> NH4OH + , pH<7, среда


 кислая
кислая
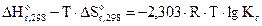 (8.1)
(8.1)
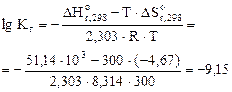
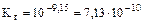 ,
,
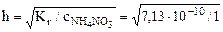 =2,67·10-5
=2,67·10-5
Т.к. среда кислая, то определяем рН:



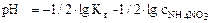 ,
,
рН = -1/2∙(-9,15)-1/2∙lg1= 4,60.
Ответ: 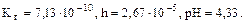
3. Что произойдет при сливании растворов хлорида железа (II) (FeCl2) и карбоната натрия (Na2CO3)? Написать уравнения реакций в ионно-молекулярной и молекулярной формах.

| РЕШЕНИЕ: До сливания в растворе каждой соли протекает ее гидролиз по I ступени (гидролизу подвергаются ионы Fe2+ и CO  ): FeCl2 Fe(OH)2 + HCl слаб. сильн. Na2CO3 NaOH + H2CO3 сильн. слаб. ): FeCl2 Fe(OH)2 + HCl слаб. сильн. Na2CO3 NaOH + H2CO3 сильн. слаб. |
|
Fe2+ +HOH <=> FeOH+ + → Н2О
CO32-+ HOH <=> HCO3-+
После сливания растворов продукт гидролиза первой соли (Н+) взаимодействует с продукт  ом гидролиза второй соли (ОН-) с образованием слабодиссоциирующего соединения Н2О, что приводит к смещению химического равновесия в сторону прямых реакций. Усиление гидролиза первой и второй соли приводит к протеканию второй ступени гидролиза с образованием осадка и выделением газа, т.е. гидролиз протекает необратимо, до конца.
ом гидролиза второй соли (ОН-) с образованием слабодиссоциирующего соединения Н2О, что приводит к смещению химического равновесия в сторону прямых реакций. Усиление гидролиза первой и второй соли приводит к протеканию второй ступени гидролиза с образованием осадка и выделением газа, т.е. гидролиз протекает необратимо, до конца.
|
FeOH+ + HOH = Fe(OH)2↓ + + → Н2О
HCO3- + HOH = H2CO3 +

CO2↑ H2O
Сокращенное ионно-молекулярное уравнение гидролиза двух солей:
Fe2+ + CO32- + H2O = Fe(OH)2↓ + CO2↑.
Молекулярное уравнение совместного гидролиза:
FeCl2 + Na2CO3 + H2O = Fe(OH)2↓ + CO2↑ + 2NaCl

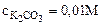 Kг - ? h - ? pH- ?
Kг - ? h - ? pH- ? 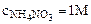 T=300K Kг-? h-? pH-?
T=300K Kг-? h-? pH-? 