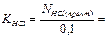ЛАБОРАТОРНАЯ РАБОТА № 1
РАБОЧАЯ ТЕТРАДЬ
По аналитической химии
Студента (тки) 1 курса факультета пищевых технологий
Дневной формы обучения
__
группы____________________________
Луганск, 2012
УДК 543(076)
Беляева В.А., Дубицкая Ж.О., Стародубцева Т.И.
Рабочая тетрадь по аналитической химии. - Луганск: ЛНАУ, 2012, - 43с.
Тетрадь предназначена для использования в качестве пособия при подготовке к выполнению и при выполнении лабораторных работ по аналитической химии студентами технологических специальностей.
Методическое пособие одобрено на заседании
Методической комиссии факультета пищевых технологий
Протокол № от _________________200 года.
ЧАСТЬ II
КОЛИЧЕСТВЕННЫЙ АНАЛИЗ
ТИТРИМЕТРИЯ (объемный анализ).
Вопросы для самоподготовки.
1. Сущность титриметрического (объемного) анализа. В чем его преимущества перед гравиметрией (весовым) анализом?
2. Перечислите требования к реакциям, применяемым в титриметрическом (объемном) анализе.
3. Что такое фактор эквивалентности, эквивалент, молярная масса эквивалентов? Какая концентрация называется молярной концентрацией эквивалентов раствора?
4. Закон эквивалентов и основное расчетное уравнение объемного анализа.
5. Поправочный коэффициент, его применение при расчетах в титриметрическом анализе.
6 Что такое точка эквивалентности и конечная точка титрования? Всегда ли они совпадают?
7. Каким образом в титриметрическом анализе определяется конечная точка титрования?
8. Какие рабочие растворы (титранты) называются стандартными (приготовленными), какие стандартизированными (установленными)? Привести примеры.
9. Как готовят в объемном анализе стандартные (приготовленные) и стандартизированные (установленные) рабочие растворы (титранты)?
10. Каким требованиям должны соответствовать вещества, используемые для приготовления стандартных растворов?
11. Способы выражения концентрации рабочего раствора (титранта) в объемном анализе. Приведите соответствующие формулы.
12. Что такое молярная концентрация эквивалентов раствора и титр раствора? Приведите соответствующие формулы.
13. Что такое титр рабочего раствора (титранта) по определяемому веществу? Приведите соответствующие расчетные формулы.
Задачи
1. Чему равен титр раствора серной кислоты по гидроксиду магния, если молярная концентрация эквивалентов H2SО4 в растворе равна 0,1моль/л?
2. Какой объем 98%-ной серной кислоты с плотностью ρ=1,84г/мл необходимо взять для приготовления 1л раствора серной кислоты с молярной концентрацией эквивалентов Н2SO4 равной 2 моль/л.
3. Что такое титр по определяемому веществу? Привести формулы для расчетов: THCl/NaOH; TNaOH/H3PO4; ТNаОН/H2C2O4·2H2O.
4. Определить титр и молярную концентрацию эквивалентов щавелевой кислоты в растворе, если навеска Н2С2О4·2Н2О массой 0,6825 г растворена в мерной колбе на 100 мл. Рассчитайте значение поправочного коэффициента для этого раствора
5. Определить молярную концентрацию раствора соляной кислоты и ее титр по Са(ОН)2, если известно, что ТНСl=0,002548 г/мл.
6. На титрование 20 мл 0,1 н раствора щавелевой кислоты (К=1,0052) израсходовали 18,31 мл раствора NаОН. Определить молярную концентрацию эквивалентов NаОН в растворе и его титр по Н2С2О4.
7. Рассчитайте объем 38%-ного раствора серной кислоты плотностью 1,290 г/мл, необходимый для приготовления 2 л 0,1 н раствора H2SO4.
МЕТОД НЕЙТРАЛИЗАЦИИ
Вопросы для самоподготовки.
1. Какая реакция лежит в основе метода нейтрализации?
2. Какие вещества определяют методом нейтрализации?
3. Как фиксируется точка эквивалентности в методе нейтрализации?
4. Какие индикаторы применяют в кислотно-основном титровании?
5. Что собой представляют индикаторы в методе нейтрализации?
6. Что такое область перехода индикатора?
7. Кривые титрования метода нейтрализации.
8. Чем руководствуются при выборе индикатора в методе нейтрализации?
9. Какой индикатор следует применять при титровании раствора NaOH соляной кислотой? А если наоборот - соляную кислоту раствором NaOH? Почему?
10. Какой индикатор следует применить при титровании щавелевой кислоты едким натром?
11. Какой индикатор следует применить при титровании соляной кислотой тетрабората натрия?
Задачи.
1. Определить молярную концентрацию эквивалентов NaOH в растворе, ТNaOH и ТNaOH/НСl, если на титрование 10 мл его пошло 11,2 мл раствора НСl с молярной концентрацией эквивалентов равной 0,1 моль/л. Какой лучше применить индикатор? Почему?
2. При титровании с метиловым оранжевым на 50 мл раствора Na2CO3, полученного растворением его навески 0,5000 г в мерной колбе емкостью 200 мл, расходуется 24 мл раствора H2SО4 . Вычислить молярную концентрацию эквивалентов H2SО4 в растворе серной кислоты и ее титр по карбонату натрия.
3. Сколько граммов НЗРО4 содержится в данном растворе, если при титровании его с фенолфталеином затрачивается 25 мл раствора с молярной концентрацией эквивалентов NaOH 0,2 моль/л?
4. Определите титр и молярную концентрацию эквивалентов в растворе щавелевой кислоты (Н2С2О4·2Н2О), если ее навеску 0,63 г растворили в мерной колбе на 100 мл. На титрование 20 мл полученного раствора израсходовали 18,31 мл раствора NаОН.
5. Определить молярную концентрацию эквивалентов NаОН в растворе и его титр по Н2С2О4∙2Н2О.
6. Определите титр и молярную концентрацию эквивалентов в растворе щавелевой кислоты (Н2С2О4·2Н2О), если ее навеску 0,63г растворили в мерной колбе на 100мл. На титрование 20 мл полученного раствора израсходовали 18,31мл раствора NаОН. Определить молярную концентрацию эквивалентов NаОН в растворе и его титр по Н2С2О4.
7. Сколько граммов серной кислоты содержится в образце, если на его титрование пошло 15 мл раствора щелочи с молярной концентрацией NaOН равной 0,1 моль/л. Какой индикатор следует применить при титровании в данном случае? Почему?
8. 7. Определить молярную концентрацию КОН в растворе, если на титрование 8 мл его расходуется 10 мл раствора соляной кислоты с молярной концентрацией эквивалентов НСl равной 0,1 моль/л. Определить титр НСl по Са(ОН)2.
9. На титрование раствора содержащего 3,158 г технического КОН, израсходовали 27,45 мл раствора НСl , ТНСl/NаОН=0,07862г/мл. Вычислить массовую долю КОН в образце.
ЛАБОРАТОРНАЯ РАБОТА № 1
“Установка титра приготовленного раствора НCl по буре”
Установочным раствором для определения титра соляной кислоты служит стандартный (приготовленный) раствор тетрабората натрия (бура) Na2B4O7∙10H2O:
Na2B4O7∙10H2O + 2HCl = 2NaCl +4H3BO3 +5H2O
Рассчитайте концентрацию раствора буры, полученного при растворении _________г тетрабората натрия Na2B4O7∙10H2O в мерной колбе емкостью 2л.. Определите значение поправочного коэффициента.
Методика определения
Приготовленный раствор HCl наливают в бюретку. В колбу для титрования емкостью 100 мл отмеривают пипеткой 10 мл 0,1н раствора буры, приливают 1-2 капли раствора метилового оранжевого (индикатор) и титруют из бюретки раствором HCl до изменения желтой окраски раствора в оранжевую, не исчезающую при взбалтывании.
Точное титрование повторяют еще 2-3 раза. Из 3-х сходящихся результатов (разность не более 0,1 мл) берут среднее.
Данные эксперимента:
К Na2B4O7 =________
N Na2B4O7 = ________моль/л
V Na2B4O7 = _______мл
 V1 HCl =______мл
V1 HCl =______мл
 V2 HCl = ______мл
V2 HCl = ______мл  VCp. HCl =_______мл
VCp. HCl =_______мл
 V3 HCl =______мл
V3 HCl =______мл
Обработка результатов:
1) Рассчитаем практическое значение молярной концентрации эквивалентов раствора соляной кислоты, используя закон эквивалентов для растворов нормальной концентрации (“золотое” правило аналитики).
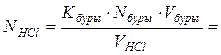
2) Рассчитаем поправочный коэффициент 0,1 н раствора соляной кислоты.