Электрохимические процессы
1.Особенности кристаллической решетки металлов, определяющие их особые свойства. Металлическая связь.
2.Электрохимические процессы на границе металла с водой или раствором его соли? Двойной электрический слой. Электродные потенциалы.
3.Стандартные электродные потенциалы металлов как мера их активности. Стандартный водородный электрод. Определение величины стандартных электродных потенциалов металлов.
4.Ряд стандартных электродных потенциалов (ряд напряжений).
5.Вычисление электродных потенциалов металлов при нестандартных условиях, уравнение Нернста.
6.Механизм возникновения тока в гальваническом элементе. Электрохимические реакции, протекающие на электродах гальванического элемента. Электродвижущая сила гальванического элемента.
7.Схемы действия гальванических элементов (Даниэля - Якоби, элемента Вольта и концентрационного элемента). Электродвижущие силы этих элементов.
8.Поляризационные явления в гальванических элементах (примеры). Способы уменьшения поляризации в гальванических элементах (деполяризаторы).
9.Вторичные (обратимые) гальванические элементы. Окислительно-восстановительные процессы, происходящие при работе свинцового (кислотного) аккумулятора.
10.Окислительно-восстановительные процессы, происходящие при работе щелочных Fe - Ni, Cd - Ni аккумуляторов.
11.Химическая коррозия металлов.
12.Механизм электрохимической коррозии металлов. Окислительно-восстановительные процессы при коррозии стали во влажной атмосфере. Изменится ли характер процессов, если атмосфера содержит кислотообразующие газы (CO2, H2S, SO2 и др.)?
13.Методы защиты металлов от коррозии (механические, химические, электрохимические). Примеры.
14.Электрохимическая защита от коррозии. Катодные и анодные покрытия.
15.Химическая защита от коррозии. Фосфатирование, оксидирование.
16.Электролиз. Влияние природы электролита на характер процессов электролиза. Электролиз расплава электролита.
17.Электролиз раствора электролита. Влияние природы анода на характер процессов электролиза. Электролиз с нерастворимым и растворимым анодом.
18.Законы Фарадея. Выход по току.
19. Определите, как изменится электродный потенциал медной пластинки, погруженной в раствор соли CuSO4 c концентрацией 0,01 моль/л, если концентрацию раствора увеличить в 10 раз ?
20. Рассчитайте, во сколько раз надо разбавить раствор соли ZnSO4, чтобы электродный потенциал цинкового электрода Zn / ZnSO4 уменьшился на 0,059 В?
21. В какой из приведенных пар металлов железо защищено от коррозии при помощи катодного покрытия: Fe-Cr, Fe-Sn? Какие окислительно-восстановительные процессы происходят при частичном повреждении катодного покрытия в условиях влажной промышленной атмосферы, содержащей СО2, H2S, SO2? Приведите схемы образующихся при этом гальванических элементов.
22. Поясните, почему химически чистое железо более стойко против коррозии, чем техническое железо? Составьте электронные уравнения анодного и катодного процессов, происходящих при коррозии технического железа в чистой влажной атмосфере и в кислой водной среде (предполагается отсутствие контакта изделия с О2).
23. Рассмотрите процессы, протекающие на электродах при электролизе расплава и водного раствора NaОН.
24. Рассмотрите процессы, протекающие на электродах при электролизе расплава и водного раствора КОН. Вычислите массу разложившейся воды и объемы водорода и кислорода при н.у., выделившихся на электролизе водного раствора КОН током силой 10 А в течение 1,5 ч.
25. Рассчитайте количество меди, выделенное на катоде при электролизе раствора CuSO4 в течение 1 ч при силе тока 4 А.
26. Рассчитайте теоретическое количество электричества, прошедшее через электролизер, если в результате реакции Cu2+ + 2 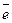
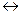 Cu на электроде выделилось 63,54 г меди.
Cu на электроде выделилось 63,54 г меди.
Литература:
| 1.Методическое пособие ч.II М.: МАДИ (ГТУ), 2005, с. 147-181. 2.Панасенко, А.А.Электролиз: метод. пособие для вузов / А.А. Панасенко, А.И. Паписова, Е.В. Полякова; под общ. ред. И.М. Паписова; МАДИ. - М., 2011. – 36 с. 3.Коровин Н.В. Общая химия, Высшая школа, 2003, раздел 3, гл. 9., §§ 9.1- 9.8. Гл.10, §§10.1 – 10.4. |
