Термохимические расчеты
Закон Гесса. Тепловой эффект химической реакции зависит от природы и состояния исходных веществ и конечных продуктов, но не зависит от пути реакции, т.е. от числа и характера промежуточных стадий.
+ О2(г)
   C(тв) СО2(г), ∆Н (путь I) + ½ О2(г), + ½ О2(г), Н1 ∆Н2, (путь II) C(тв) СО2(г), ∆Н (путь I) + ½ О2(г), + ½ О2(г), Н1 ∆Н2, (путь II) |
СО(г)
Например, процесс окисления углерода С(тв) до СО2(г) можно осуществить как через стадию непосредственного сгорания углерода до углекислого газа с тепловым эффектом ∆Н (путь I), так и через стадию образования промежуточного продукта − окиси углерода − СО(г) с тепловым эффектом ∆Н1, с последующим окислением СО(г) до СО2(г) с тепловым эффектом ∆Н2 (путь II) в соответствии с уравнениями реакций:
С(тв) + О2(г) 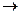 СО2(г), ∆Н (I)
СО2(г), ∆Н (I)
С(тв) + ½О2(г) 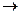 СО(г), ∆Н1
СО(г), ∆Н1
СО(г) + ½О2(г) 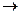 СО(г), ∆Н2 (II)
СО(г), ∆Н2 (II)
--------------------------------------------------
С(тв) + О2(г) 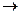 СО2(г), ∆Н1+ ∆Н2.
СО2(г), ∆Н1+ ∆Н2.
Из сопоставления тепловых эффектов реакций следует, что ∆Н=∆Н1+∆Н2, т.е. каким бы путем не осуществлялась реакция, ее тепловой эффект будет одинаков, если не меняется конечное и исходное состояния системы.
Закон Гесса позволяет рассчитать энтальпию химических реакций.
Энтальпия химической реакции ∆Но298,реакции равна разнице суммы стандартных энтальпий образования продуктов реакции и исходных веществ с учетом стехиометрических коэффициентов:
∆Но298,реакции=∑∆Но298,продукты реакции –∑∆Но298,исходные вещества.
В общем случае, для реакции в стандартных условиях
аА(г) + bВ(г) → сС(г) + dD(г),
∆Но298,реакции =[c∆НоC(г)+d∆НоD(г)]−[a∆НоA(г)+b∆НоB(г)], кДж,
где ∆Но298,реакции – энтальпия химической реакции, кДж; ∆НоА(г), ∆НоВ(г), ∆НоС(г), ∆НоD(г)) – стандартные значения энтальпий образования веществ, участвующих в реакции, кДж/моль; а, b, c, d – стехиометрические коэффициенты в уравнении реакции.
Можно также рассчитать значение стандартной энтальпии образования одного из исходных веществ или продуктов, если известны энтальпии образования остальных реагентов и энтальпия химической реакции.
Например, для реакции
аА(г) + bВ(г) → сС(г) + dD(г), ∆Но298,реакции>0.
∆НоA(г) =c∆НоC(г)+d∆НоD(г)−b∆НоB(г)−∆Но298,реакции, кДж/моль А(г).
Зная теплоты образования веществ, можно определить и их теплоты разложения по закону Лавуазье-Лапласа:
При разложении сложного вещества на простые поглощается (или выделяется) столько же теплоты, сколько выделяется (или поглощается) при его образовании из простых веществ в тех же условиях.
Так, если
Н2О(г) → Н2(г) + ½О2(г) , ∆Но298,реакции=241,8 кДж,
то
Н2(г) + ½О2(г) → Н2О(г), ∆Но298,реакции=−241,8 кДж.
3.7. Понятие об энтропии и второй закон термодинамики
Первый закон термодинамики позволяет определить тепловые эффекты химических реакций (но не направление реакций в данных условиях). Датский химик Ю. Томсен, а затем французский химик М. Бертло высказали предположение о том, что химические процессы самопроизвольно идут только с выделением теплоты, т.е. с уменьшением энтальпии системы (с экзотермическим эффектом, ∆Н< 0).
Однако известно много примеров, когда химические реакции самопроизвольно протекают с поглощением теплоты, и, более того, одни и те же реакции в зависимости от условий могут идти как в прямом, так и в обратном направлениях. Решить вопрос о направлении химической реакции в данных условиях можно на основании закономерностей, вытекающих из второго закона термодинамики (и, в первую очередь, представления о термодинамической функции состояния, называемой энтропией).
