Задания для контрольной работы
Рассчитать эквивалент химических соединений
| № варианта | Класс соединений |
| Оксид кадмия (II),оксид теллура (IV), гидроксид лития, сероводородная кислота, перманганат калия | |
| 62. | Оксид меди (I), оксид хлора (V), гидроксид магния, хлороводородная кислота, карбонат алюминия |
| 63. | Оксид кобальта (III), оксид бериллия, гидроксид рубидия, йодоводородная кислота, гипохлорит натрия |
| 64. | Оксид железа (II), оксид азота (V), гидроксид стронция, бромоводородная кислота, сульфат меди (II) |
| 65. | Оксид марганца (IV), оксид германия (II), гидроксид олова (II), Селеноводородная кислота, нитрат бария |
| Оксид молибдена (VI), оксид углерода (II), гидроксид золота (III), Фтороводородная кислота, гидрокарбонат магния | |
| Оксид хрома (III), оксид бора, гидроксид аммония, уксусная кислота, хлорат кальция | |
| Оксид титана (IV), оксид натрия, гидроксид хрома (III), муравьиная кислота, сульфит железа (II). | |
| Оксид ванадия (V), оксид олова (IV), гидроксид железа (II),серная кислота, цианид калия | |
| Оксид скандия (III), оксид брома (VII), гидроксид таллия (I), сернистая кислота, гидрокарбонат кальция | |
| Оксид ксенона (VIII), оксид сурьмы(V), гидроксид меди (II), кремниевая кислота, ацетат цинка |
Продолжение таблицы 4.2
| Оксид цинка (II), оксид селена (VI), гидроксид марганца (IV) , азотная кислота, хлорид натрия | |
| Оксид никеля (IV), оксид фосфора (III), гидроксид цинка, мышьяковая кислота, формиат бария | |
| Оксид хрома (VI), оксид мышьяка (V), гидроксид бария, угольная кислота, дихромат калия | |
| Оксид золота (III), оксид сурьмы (V), гидроксид никеля(II), ортофосфорная кислота, фторид алюминия | |
| оксид хрома (VI), оксид фосфора (III), гидроксид кобальта (II), мышьяковистая кислота, йодид никеля(II) | |
| оксид углерода (IV), оксид марганца (VII), гидроксид аммония, фтороводородная кислота, силикат калия | |
| Оксид йода(I), оксид калия, гидроксид кальция, марганцевая кислота, карбонат алюминия. | |
| оксида хрома(VI), азотистая кислота, гидроксид марганци(II), хлорноватистая кислота, сульфата олова(II). | |
| Оксида азота(III), оксид цезия, гидроксид бария, тиосерная кислота, сульфита стронция. |
5. СТРОЕНИЕ АТОМА. ПЕРИОДИЧЕСКИЙ ЗАКОН И ПРИОДИЧЕСКАЯ ТАБЛИЦА Д.И. МЕНДЕЛЕЕВА.
Атом и его строение
Атом любого элемента состоит из положительно заряженного ядра и вращающихся вокруг него отрицательно заряженных электронов, в целом же атом – система электронейтральная. Атомное ядро состоит из нуклонов: протонов (заряд +1, массовое число 1) и нейтронов (заряд 0, массовое число 1). Заряд ядра, равный порядковому номеру элемента в таблице Д.И. Менделеева, совпадает с числом протонов: массовое число ядра равно суммарному количеству протонов и нейтронов. У одного элемента возможно существование атомов с различным массовым числом ядер – изотопов, т.е. атомов с различным числом нейтронов и одинаковым числом протонов.
Согласно современным представлениям, электрон обладает одновременно свойствами волны и частицы,
Основные положения состояния электрона в атоме Н. Бор сформулировал в виде следующих постулатов:
1) электрон может вращаться вокруг ядра только по некоторым определенным круговым орбитам (стационарным орбитам);
2) Двигаясь по стационарной орбите, электрон не излучает электромагнитной энергии;
3) Излучение происходит при скачкообразном переходе электрона с одной стационарной орбиты на другую.
Строение атомов выражается электронной и электронно-графической формулой.
Например, строение атома фтора выражается электронной формулой 1s22s22p5 и электронно-графической формулой:
2s 2p
| 1s | ¯ | ¯ | ¯ | | ||
| ¯ | ||||||
Состояние электрона в атоме характеризуется волновой функцией, являющейся решением волнового уравнения Шредингера. Из математического анализа уравнения вытекает дискретность значений энергии электрона, момента количества орбитального движения и проекции этого момента на выделенное в пространстве направление. Дискретность выражается квантовыми числами: главным – n, орбитальным – l, магнитным - ml . Четвёртое квантовое число - ms, называют спиновым. Волновая функция при определённых значениях трёх квантовых чисел (n, l ,ml) описывает состояние электрона, характеризующееся так называемой атомной орбиталью (АО).
Каждой АО соответствует область пространства определённого размера, формы и ориентации, равноценная понятию электронного облака. Электронное облако не имеет чётких границ, в связи с этим введено понятие граничная поверхность, т.е. поверхность с равной электронной плотностью, ограничивающая объём, который включает 90% заряда и массы электрона. Форма и размер граничной поверхности считается формой и размером электронного облака.
Главное квантовое число – n определяет энергию АО и номер энергетического уровня, на котором находится электрон (т.е. допустимые уровни энергии электрона) и может принимать значения от единицы до бесконечности.
Орбитальное квантовое число – 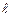 определяет форму АО и энергетический подуровень (т.е. квантование вытянутости эллиптической орбиты) и может принимать значения от нуля до n-
определяет форму АО и энергетический подуровень (т.е. квантование вытянутости эллиптической орбиты) и может принимать значения от нуля до n- 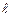 .
.
Магнитное квантовое число – ml определяет пространственную ориентацию данной АО и отчасти её форму (т.е. ориентацию электронных облаков в пространстве) и может принимать значения от – 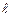 …0…+
…0…+ 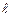 .
.
Спиновое квантовое число – ms характеризует собственный момент импульса и связанный с ним магнитный момент (т.е. вращение электрона вокруг оси), и может принимать значения ± 1/2.
Число АО в пределах энергетического подуровня определяется числовым значением магнитного квантового числа (2 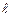 +1). Число АО в пределах всего энергетического уровня равно сумме АО всех его подуровней.
+1). Число АО в пределах всего энергетического уровня равно сумме АО всех его подуровней.
При заполнении атомных орбиталей действует принцип Паули (или запрет Паули), согласно которому в атоме не может быть двух электронов, у которых все четыре квантовых числа одинаковые. Основным следствием этого принципа является то, что на одной атомной орбитали не может находиться более двух электронов. Состояние электронов в атоме должно отличаться значением хотя бы одного квантового числа. При переходах электронов с одной орбиты на другую атом поглощает или излучает энергию.
Принцип Паули определяет ёмкость (максимальное число электронов) энергетических уровней и подуровней, которая соответственно равна 2n2 и 2(2 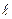 +1) т.е. удвоенному числу АО.
+1) т.е. удвоенному числу АО.
Заполнение энергетических подуровней подчиняется правилу Хунда, согласно которому устойчивому состоянию атома соответствует такое распределение электронов в пределах энергетического подуровня, при котором абсолютное значение суммарного спина атома максимально. Например, четыре валентных p – электрона атома кислорода размещаются в квантовых ячейках следующим образом:
2p
| ¯ | | |
Закономерная последовательность заполнения энергетических уровней и подуровней в атомах с увеличением порядкового номера элемента выражается правилами Клечковкого, которые называют правилом суммы n+ 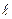 . Согласно I-му правилу Клечковского, при росте заряда ядра атома последовательное заполнение электронных орбиталей происходит от орбиталей с меньшим значением суммы главного и орбитального квантовых чисел к орбиталям с большим значением этой суммы. При одинаковом значении этой суммы порядок заполнения электронами энергетических подуровней определяется II-ым правилом Клечковского: при одинаковых значениях суммы главного и орбитального квантовых чисел заполнение орбиталей происходит последовательно в направлении возрастания значения главного квантового числа. Т.о. первым заполняется подуровень с меньшим значением n в этой сумме:
. Согласно I-му правилу Клечковского, при росте заряда ядра атома последовательное заполнение электронных орбиталей происходит от орбиталей с меньшим значением суммы главного и орбитального квантовых чисел к орбиталям с большим значением этой суммы. При одинаковом значении этой суммы порядок заполнения электронами энергетических подуровней определяется II-ым правилом Клечковского: при одинаковых значениях суммы главного и орбитального квантовых чисел заполнение орбиталей происходит последовательно в направлении возрастания значения главного квантового числа. Т.о. первым заполняется подуровень с меньшим значением n в этой сумме:
1 s ® 2 s ® 2 p ® 3 s ® 3 p ® 4 s ® 3 d ® 4 p ® 5 s ®
4 d ® 5 p ® 6 s ® …
Правила Клечковского позволяют заранее предвидеть появление в периодической системе Д.И. Менделеева рядов из d - , а затем из f - элементов, которые находятся между s – и p – элементами больших периодов.
Если на валентных энергетических уровнях имеются вакантные АО, то при возбуждении атома (получении ими порции энергии) становится возможным «разъединение» валентных электронов, то есть их переходы с тех подуровней, где все АО заняты полностью ( ¯) или частично (¯) на другие валентные подуровни того же уровня, имеющие незаполненные АО. При этом с тех АО, которые в основном (соответствующем минимальной энергии атома) состоянии были заняты полностью, «уходит» по одному электрону последовательно, т.е. возможно несколько возбуждённых состояний. Возбуждение меняет валентное состояние атома (число его неспаренных электронов). Например, валентными электронами атома осмия в основном состоянии являются следующее: 5d6 6s2. Их распределение по квантовым ячейкам:
5d 6s
| ¯ | | | | | ¯ |
(атом осмия находится в 4–валентном состоянии).
При этом как на пятом, так и на шестом уровнях имеются вакантные АО. Получение атомом осмия двух последовательных порций энергии приводит к следующим возбуждённым состояниям - атом осмия находится: 1) в шести валентном состоянии; 2) в 8 – валентном состоянии.
1869 Г. Д.И.Менделеев впервые сформулировал периодический закон. Данные о строении ядра и распределении электронов в атоме позволили дать новую формулировку закона:
Свойство простых веществ, а также формы и свойства соединений элементов находятся в периодической зависимости от заряда ядра атома.
Периодически таблица - есть график, отображения периодического закона.
