Задания для контрольной работы. 261. В два сосуда с голубым раствором медного купороса поместили в первый цинковую
261. В два сосуда с голубым раствором медного купороса поместили в первый цинковую пластинку, а во второй серебряную. В каком сосуде цвет раствора постепенно пропадет? Почему? Составьте электронные и молекулярные уравнения соответствующей реакции.
262. Увеличится, уменьшится или останется без изменения масса цинковой пластинки при взаимодействии ее с растворами: а) CuSO4; б) MgSO4; в) Pb(NO3)2? Почему? Составьте электронные и молекулярные уравнения соответствующих реакций.
263. При какой концентрации Zn2+ (в моль/л) потенциал цинкового электрода будет на 0,015В меньше его стандартного электродного потенциала? Ответ: 0,30 моль/л.
264. Увеличится, уменьшится или останется без изменения масса кадмиевой пластинки при взаимодействии ее с растворами: а) AgNO3; б) ZnSO4; в) NiSO4? Почему? Составьте электронные и молекулярные уравнения соответствующих реакций.
265. Марганцевый электрод в растворе его соли имеет потенциал -1,23В. Вычислите концентрацию ионов Mn2+(в моль/л). Ответ: 1,89∙10-2 моль/л.
266. Потенциал серебряного электрода в растворе AgNO3 составил 95% от значения его стандартного электродного потенциала. Чему равна концентрация ионов Ag+ (в моль/л)? Ответ:0,20 моль/л.
267. Составьте схему, напишите электронные уравнения электродных процессов и вычислите ЭДС медно- кадмиевого гальванического элемента, в котором [Cd2+]=0,8 моль/л, а [Cu2+]=0,01 моль/л. Ответ: 0,68 В.
268. Составьте схемы двух гальванических элементов, в одном из которых медь была бы катодом, в другом – анодом. Напишите для каждого из этих элементов электронные уравнения реакций, протекающих на катоде и аноде.
269. При какой концентрации ионов Сu2+ (моль/л) значение потенциала медного электрода становится равным стандартному потенциалу водородного электрода? Ответ: 1,89∙10-12 моль/л.
270. Какой гальванический элемент называется концентрационным? Составьте схему, напишите электродные уравнения электродных процессов и вычислите ЭДС гальванического элемента, состоящего из серебряных электродов, опущенных: первый в 0,01 н, а второй – в 0,1 н растворы AgNO3. Ответ: 0,059 В.
271. При каком условии будет работать гальванический элемент, электроды которого сделаны из одного и того же металла? Составьте схему, напишите электронные уравнения электродных процессов и вычислите ЭДС гальванического элемента, в котором один никелевый электрод находится в 0,001 М растворе, а другой такой же электрод – в 0,01 М растворе сульфата никеля. Ответ: 0,0295 В.
272. Составьте схему, напишите электронные уравнения электродных процессов и вычислите ЭДС гальванического элемента, состоящего из свинцовой и магниевой пластин. 
щенных в растворы своих солей с концентрацией [Pb2+] = [Mo2+] = 0,01 моль/л. Изменится ли ЭДС этого элемента, если концентрацию каждого их ионов увеличить в одинаковое число раз? Ответ: 2,244 VH 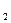 В.
В.
273. Составьте схемы двух гальванических элементов, в одном из которых никель является катодом, а в другом – анодом. Напишите для каждого из этих элементов электронные уравнения реакций, протекающих на катоде и на аноде.
274. Железная и серебряная пластины соединены внешним проводником и погружены в раствор серной кислоты. Составьте схему данного гальванического элемента и напишите электронные уравнения процессов, происходящих на аноде и на катоде.
275. Составьте схему, напишите электронные уравнения электродных процессов и вычислите ЭДС гальванического элемента, состоящего их пластин кадмия и магния, опущенных в растворы своих солей с концентрацией [Mg2+] = [Cd2+] = 1моль/л. Изменится ли значение ЭДС, если концентрацию каждого их ионов понизить до 0,01моль/л. Ответ: 1,967В.
276. Составьте схему гальванического элемента, состоящего из пластин цинка и железа, погруженных в растворы их солей. Напишите электронные уравнения процессов, протекающих на аноде и на катоде. Какой концентрации надо было взять ионы железа (моль/л), чтобы ЭДС элемента стала равна нулю, если [Zn2+] = 0,001моль/л. Ответ: 7.3 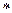 10-15моль/л.
10-15моль/л.
277. Составьте схему гальванического элемента, в основе которого лежит реакция, протекающая по уравнению:
Ni + Pb(NO3)2 = Ni(NO3)2 + Pb
Напишите электронные уравнения анодного и катодного процессов. Вычислите ЭДС этого элемента, если [Ni2+] = 0,01моль/л, а [Pb2+] = 0,0001моль/л. Ответ: 0,064В.
278. Какие химические процессы протекают на электродах при зарядке свинцового аккумулятора?
279. Какие химические процессы протекают на электродах при зарядке и разрядке кадмий-никелевого аккумулятора?
280. Какие химические процессы протекают на электродах при зарядке и разрядке железо-никелевого аккумулятора?
ЭЛЕКТРОЛИЗ
15.1.Электролизом называется совокупность окислительно-восстановительных процессов, которые протекают при пропускании постоянного электрического тока через раствор или расплав электролита. Под влиянием электрического тока движение ионов становится направленным: отрицательные анионы перемещаются к положительно поляризованному аноду, а положительные катионы - к катоду, который соединён с отрицательным полюсом источника питания.
На катоде идёт процесс восстановления, а на аноде - окисления.
При электролизе катод служит восстановителем (отдает электроны катионам), а анод – окислителем (принимает электроны от анионов). Сущность электролиза состоит в осуществлении за счет электрической энергии химических реакций – восстановления на катоде (К) и окисления на аноде (А). Эти процессы называются процессами (реакциями) электровосстановления и электроокисления. Восстановительное и окислительное действие электрического тока во много раз сильнее действия химических окислителей и восстановителей.
