Пример образования химической связи в соединении
Рассмотрим образование химической связи в молекуле ВН3
В+3Н-3 – атом бора является центральным атомом.
ц.а.
В - нормальное состояние В* возбужденное состояние
| | | | ||||||
| ¯ | 2p | | 2p |
2s 2s
Валентность (число химических связей) равна 3. В гибридизации участвуют одна 2s- и две 2р- орбитали. Образуются три гибридные орбитали:
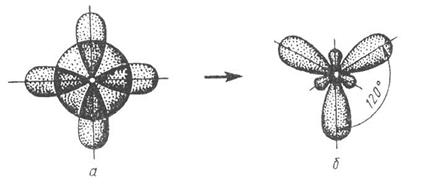 |
Рис. 10. Схема sp2-гибридизации
Так как число периферийных атомов равно трем, то все атомы связаны s (сигма) связью, а следовательно тип гибридизации-sp2, валентный угол связей равен 1200, формула молекулы – плоский треугольник.
Вид гибридизации легко определить по структурной формуле вещества.
Например:
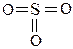
| | | |||||||
| | | | 3d | |||||
| | 3p |
3s
Центральный атом – S (В = 6), с.о.= +6, значит, электроны располагаются по одному на шести орбиталях: 3s, 3p, 3d. У серы – три переферийных атома, 3 p-связи, значит, 2 электрона d-орбитали и 1 электрон р-орбитали в гибридизации не участвуют. Отсюда – гибридизация серы -sp2, угол связи 1200, молекула треугольная.
Рекомендуемая литература: [1], с. 97-167; [2], с. 35-64.
Комплексные соединения - это соединения, характеризующиеся наличием ковалентных связей, образованных по донорно-акцепторному механизму. Это сложные вещества, в которых можно выделить:
1) внутреннюю сферу, в которую входят центральный атом (ион) – комплексообразователь и связанных, с ним донорно-акцепторными связями – лиганды;
2) внешнюю сферу, связанную с внутренней ионной связью.
Типичными комплексообразователями являются ионы d-металлов и некоторые ионы р-металлов, обладающие акцепторными свойствами благодаря наличию в их структуре свободных орбиталей.
Лиганды — частицы (молекулы или ионы), обладающие неподеленной парой электронов (доноры электронов): H2O, NH3, Cl-, Br-, J-, F-, CN-, OH-, CO и др.
Число лигандов во внутренней сфере называется координационным числом. Координационное число зависит от заряда центрального иона, и, как правило, в 2 раза больше него. Координационное число не является строго определенной величиной для данного иона. Для комплексообразующих ионов установлены следующие координационные числа:
| заряд центрального иона: | +1 | +2 | +3 | +4 |
| координационное число: | 4, 6 | 4, 6 |

Например: [Ag+(NH3)2]+Cl-
Ag+  |  | |||||||||
| 4d |  | 5p | ||||||||
| ¯ | ¯ | ¯ | ¯ | |
|
|
|
|
Донорно-акцепторная связь в комплексах образуется за счет объединения валентной пары электронов атома лиганда (молекула аммиака) и вакантной орбитали комплексообразователя путем их взаимного перекрывания (s и р орбитали), в результате чего эта пара становиться общей для обоих атомов.
Форма комплексного иона определяется типом гибридизации атомных орбиталей центрального атома иона. У серебра задействованы две орбитали, значит это sp-гибридизация, комплекс имеет линейную форму.
Теория строения комплексных соединений предложена А. Вернером.
| Заряд центрального атома | Координационное число | Форма комплексного иона | Примеры |
| +1 | Линейная | [Ag(NH3)2]Cl | |
| +2 | редко 6 | Тетраэдрическая Плоская квадратная | [Cu(NH3)4]Cl2 K4[Fe(CN)6] |
| +3 | редко 4 | Октаэдрическая Шестиугольная призматическая | K3[Al(OH)6] K [Al(OH)4] |
Комплексные соединения бывают:
а) анионные (комплексный анион) – K4[Fe(CN)6];
б) катионные (комплексный катион) – [Cu(NH3)4]Cl2;
в) катионанионные (комплексный анион и катион) – [Cu(NH3)4][PtCl4];
г) нейтральные (комплексная группа нейтральная) – [Fe(CO)5]0
