Активации с экзотермичностью. Медленная стадия
Что необходимо для того, чтобы произошла реакция? Рассмотрим это на примере взаимодействия атома хлора с метаном. Во-первых, молекула метана и атом хлора должны столкнуться. Во-вторых, столкнувшиеся частицы должны обладать необходимой для реакции энергией. Если кинетическая энергия этих частиц мала, при соударении они просто отталкиваются друг от друга. Минимальное количество энергии, необходимое для того, чтобы осуществилось превращение, называется энергией активации. В-третьих, в момент столкновения молекула метана и атом хлора должны быть ориентированы определенным образом (фактор вероятности).
Рассмотрим ход этой реакции. Частицы CI· и СН4 движутся и обладают некоторой кинетической энергией. Они сталкиваются, и кинетическая энергия превращается в потенциальную. Если в потенциальную энергию превращается достаточное для реакции количество кинетической энергии, начинается перестройка электронных оболочек частиц - достигается переходное состояние: связь углерод-водород растянута, но еще не разорвана, а связь водород-хлор начала образовываться, но еще не образовалась. В результате реакции образуются частицы СН3· и НСl. Их потенциальная энергия быстро превращается в кинетическую, они разлетаются в разные стороны. Тепло отдается окружающему пространству.
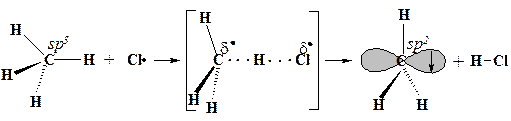 | ||
| тетраэдрический атом углерода | углерод становится почти плоским | плоский метильный радикал |
| ИСХОДНЫЕ СОЕДИНЕНИЯ | ПЕРЕХОДНОЕ СОСТОЯНИЕ неспаренный электрон одновременно принадлежит атомам хлора и углерода | КОНЕЧНЫЕ ПРОДУКТЫ |
На рисунках 1.3 и 1.4 показано изменение потенциальной энергии в стадиях роста цепи реакций хлорирования и бромирования метана. Реакции (2) соответствует левая ветвь энергетической диаграммы, реакции (3) - правая ветвь. Свободная энергия переходного состояния соответствует вершине энергетического барьера.
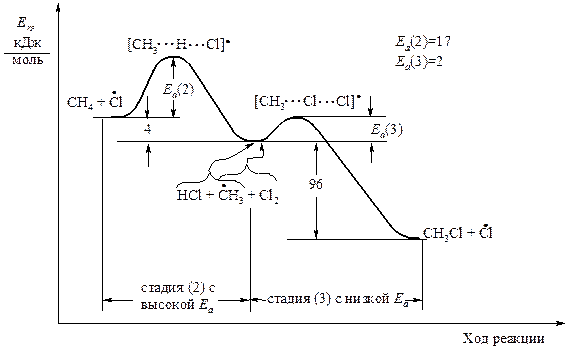
Рис. 1.3. Энергетическая диаграмма стадий роста цепи в реакции
Хлорирования метана
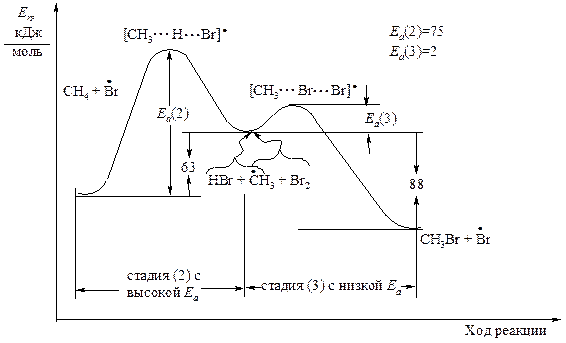
Рис. 1.4. Энергетическая диаграмма стадий роста цепи в реакции
Бромирования метана
Существует общее правило:
| в свободнорадикальных реакциях углеводородов энергия активации уменьшается с увеличением экзотермичности. |
Какая же из двух реакций роста цепи, следующих одна за другой, - (2) или (3) - протекает медленнее? Очевидно, реакция (2) с высокой энергией активации протекает труднее. В реакции (3) метильный радикал легко реагирует с молекулой брома или хлора. В дальнейшем мы будем руководствоваться следующим правилом:
