Окислительное фосфорилирование
После завершения цикла Кребса водород, отобранный от окисленных субстратов, находится в форме НАДН+Н+, то есть связан с коферментами дегидрогеназ. На следующем этапе происходит окисление восстановленных коферментов путем дегидрирования до воды, одновременно с этим за счет энергии окисления образуется АТФ. Эти окислительные процессы можно представить следующим образом:
S*Н2 + ½ О2 → S + H2О
Очевидно, что этот процесс по конечному результату сходен с реакцией горения водорода в кислороде:
 Н2 + ½ О2 Н2О ΔG0 = -100 кДж/моль
Н2 + ½ О2 Н2О ΔG0 = -100 кДж/моль
 2Н – 2е 2Н+
2Н – 2е 2Н+
 О0 + 2е О-2
О0 + 2е О-2
За счет этой энергии происходит синтез АТФ. Известно, что максимально полезная работа получается при полностью обратимом процессе, реальные же процессы всегда не обратимы, поэтому величина полезной работы будет тем больше, чем в большей степени процесс приближается к равновесному. Организм превращает в полезную работу приблизительно 40% той энергии, которая выделяется при окислении субстратов и достигается это постепенным переносом протонов и электронов от субстратов к молекулярному кислороду. Увеличение числа промежуточных стадий способствует приближению реального процесса к равновесному, весь процесс тканевого дыхания протекает в митохондриях клетки. Митохондрия имеет форму цилиндра с закругленными краями, количество митохондрий в клетках различно : от 100-2 тысяч, они имеют внутреннюю и наружную мембраны, разделенные межмембранным пространством. Внутренние мембраны образуют складки – это так называемые кристы, содержимое пространство, которое ограничено внутренней мембраной, называется матриксом. Внутренние и внешние мембраны отличаются по составу и функциям, так, внешние мембраны проницаемы для молекул с молекулярной массой до 5 тысяч, а проницаемость внутренних мембран ограничена, следовательно, состав матрикса и состав межмембранного пространства отличается. Матрикс на 50 % состоит из белков, а во внутренней мембране митохондрий встроен ферментный ансамбль дыхательной цепи, который называется цепью передачи электронов – ЦПЭ. Ансамбль состоит из трех жесткозакрепленных ферментных комплексов , первый ферментный комплекс состоит из дегидрогеназ с коферментом ФМН, который переносит водород с НАДН на ФМН и далее на кофермент Q (убихинон).
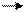 НАДН + Н+ + ФМН ФМН*Н2 + НАД+
НАДН + Н+ + ФМН ФМН*Н2 + НАД+
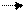 ФМН*Н2 + Q ФМН + Q* Н2
ФМН*Н2 + Q ФМН + Q* Н2
Перенос водорода включает в себя много этапов, участвует ряд промежуточных переносчиков, разделяющих отдельно перенос электронов и протонов, в этом переносе участвуют цитохромы, представляющие собой гемопротеины. Атом железа в геммах цитохрома может менять валентность :

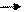 Fe3+ + e Fe2+
Fe3+ + e Fe2+
Рис.: Сопряжение дыхания и синтеза АТР (окислительного фосфорилирования).
I – NADH – дегидрогеназа; II – сукцинатдегидрогеназа; III – OH2 – дегидрогеназа; IV - цитохромоксидаза; V – АТР – синтаза.
 Наружная мембрана митохондрий
Наружная мембрана митохондрий




 Межмембранное пространство
Межмембранное пространство
 nH+ nH+ nH+
nH+ nH+ nH+





 + + ++ + +
+ + ++ + +




 Внутренняя 2e- Q 2e-
Внутренняя 2e- Q 2e-
 Мембрана 2e- 2e- 2e-
Мембрана 2e- 2e- 2e-
Митохондрий
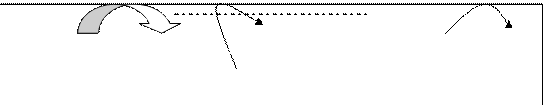 |
 NADH NAD+ Фумарат 1/2О2 Н2О
NADH NAD+ Фумарат 1/2О2 Н2О


 Сукцинат V
Сукцинат V


 Оксалоацетат Малат ADP + H3PO4
Оксалоацетат Малат ADP + H3PO4



 H+
H+
ATP


 АТР
АТР
Матрикс
АDP


 Присоединение электрона в такой структуре и его отдача вызывают изменение лишь электронной конфигурации атома металла, не затрагивая структуру белков. Цитохромы дыхательных путей обозначаются как: b, c1, с, a a3 и располагаются в цепи между убихиноном и кислородом: b c1 с a a3
Присоединение электрона в такой структуре и его отдача вызывают изменение лишь электронной конфигурации атома металла, не затрагивая структуру белков. Цитохромы дыхательных путей обозначаются как: b, c1, с, a a3 и располагаются в цепи между убихиноном и кислородом: b c1 с a a3

 Кроме железа, входящего в состав цитохромов, в митохондриях имеются белки, содержащие негемовое железо, их называют железосерными белками. В них атомы железа связаны с атомами серы боковых цистеиновых остатков аминокислот:
Кроме железа, входящего в состав цитохромов, в митохондриях имеются белки, содержащие негемовое железо, их называют железосерными белками. В них атомы железа связаны с атомами серы боковых цистеиновых остатков аминокислот:


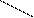
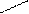
|
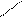
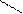 цис - S S – цис
цис - S S – цис 
 цис - S S – цис
цис - S S – цис
Железосерные белки входят в комплекс дыхательной цепи, выполняя роль простетической группы в процессе переноса электронов. Комплекс III, цитохромов b, c1 действует как QH2 - дегидрогеназа:
 QH2 + 2с (Fe3+) Q + 2Н+ + 2с (Fe2+)
QH2 + 2с (Fe3+) Q + 2Н+ + 2с (Fe2+)
Электроны последовательно проходят через атомы железа цитохромов b, c1 функционируют как Q∙H2 - дегидрогеназа, а протоны высвобождаются в раствор. Стехиометрический коэффициент 2 перед цитохромом с означает, что с QH2 передается 2 электрона, а цитохромы за один цикл могут передать только 1 электрон. Комплекс IV, действует как цитохромоксидаза, он помимо гемма содержит ионы меди, которые тоже участвуют в переносе электронов с цитохрома с на кислород, при этом электроны соединяются последовательно к ионам железа а1, а3, затем к меди, затем к кислороду. Кислород, поступающий в митохондрии из крови, связывается с атомом железа в цитохроме а3 в форме молекулы кислорода в молекулярном виде. Затем каждый из атомов молекулы кислорода последовательно присоединяет по два электрона и по два протона, превращаясь в молекулу воды. В дыхательной цепи имеется комплекс II, где осуществляется перенос электронов от сукцината, образующегося в цикле Кребса, направление потока электронов в дыхательной цепи при сопряжении одной окислительно-восстановительной системы с другой определяется их стандартными окислительно-восстановительными Red/Ox потенциалами. Эти величины для компонентов цепи и субстратов приведены в таблице, их величины:
| КОМПОНЕНТ | СИСТЕМА | Е0, В |
| 1) Дыхательная цепь | НАД+/НАДН+Н+ | -0,32 |
| ФМН/ ФМН* Н2 | -0,12 | |
| ФАД/ ФАД* Н2 | -0,05 | |
| Q/ QH2 | 0,0 | |
| Цитохром b (Fe3+, Fe2+) | 0,07 | |
| Цитохром с1 (Fe3+, Fe2+) | 0,22 | |
| Цитохром с (Fe3+, Fe2+) | 0,26 | |
| Цитохром а (Fe3+, Fe2+) | 0,29 | |
| Цитохром а3 (Fe3+, Fe2+) | 0,55 | |
| ½ О2/ Н2О | 0,82 | |
| 2) Субстраты | Фумарат/ Сукцинат | 0,03 |
| ЩУК/ Малеиновая кислота | -0,17 | |
| Пируват/ Лактат | -0,19 |
В связи с тем, что Red/Ox потенциалы определяют сродство к электрону, то для любых двух пар система с более положительным потенциалом будет стремиться принимать электроны и, как видно, в дыхательной цепи Red/Ox потенциалы переносчика электронов становятся более положительными. Поэтому, электроны передаются в дыхательной цепи внутри мембраны, а протоны высвобождаются в межмембранное пространство. Протоны необходимы для восстановления той ФМН, которая поступает из матрикса.
Таким образом, ЦПЭ работает как протонный насос, перекачивая ионы водорода из матрикса на наружную сторону мембраны, в результате , по разные стороны от внутренней мембраны возникает разность концентраций ионов водорода и одновременно разность потенциалов на поверхности. Следовательно, разность окислительно-восстановительных потенциалов трансформируется в энергию ΔµН+. Электрохимический потенциал заставляет протоны двигаться с наружной поверхности во внутреннюю, однако, мембраны в обратном направлении не проницаема для них, за исключением протонных каналов (V комплекс). В области этих каналов на внутренней поверхности внутренней мембраны располагается фермент Н+ АТФ-синтетаза, катализирующая синтез АТФ. Образующиеся молекулы, которые транспортируются из матрикса на наружную сторону мембраны и попадают в цитозоль. На синтез 1-ой молекулы АТФ, Δ Е0>0,2 В, требуется энергия не менее 31 кДж/моль, то есть в дыхательной цепи имеются 3 участка (I, III, IV), где высвобождение энергии достаточно для синтеза АТФ, следовательно, перенос пары электронов от НАДН в итоге дает нам образование 3-х молекул АТФ, а ФАД – 2-х молекул АТФ. Известно, что человек за сутки из воздуха потребляет приблизительно 67 литров (27 молей) кислорода, подавляющая его часть (90%) восстанавливается до воды при участии дыхательной цепи, за это же время в митохондриях синтезируется 62 кг АТФ, однако, содержание АТФ в организме составляет около 50 грамм, вследствие того, что каждая молекула АТФ расщепляется и регенерируется 2,5 тыс. раз в сутки, средняя продолжительность ее жизни меньше 1-ой минуты.
Биосинтезы
