Кинетика химической коррозии
В процессе окисления на поверхности металла образуется твердая пленка оксидов. Для продолжения коррозии необходимо, чтобы ионы металла или кислород диффундировали через эту пленку Через пленку диффундируют ионы металла, т.к. их радиус меньше радикса атома. В том же направлении двигается электроны. С границы газ — пленка двигаются атомы кислорода, т.к. их радикс меньше, чем у ионов. Атомы кислорода в пленке ионизируются и образуют оксиды. Скорость окисления зависит от сплошности и защитных свойств пленки. Свойства оксидных пленок зависят от следующих условий:
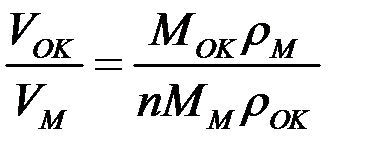 (1)
(1)
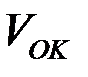 — объем оксида;
— объем оксида; 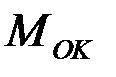 — молярная масса оксида;
— молярная масса оксида; 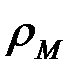 — плотность металла;
— плотность металла; 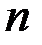 — число атомов металла в молекуле оксида;
— число атомов металла в молекуле оксида; 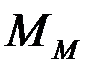 — молярная масса металла;
— молярная масса металла; 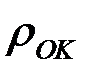 — плотность оксида.
— плотность оксида.
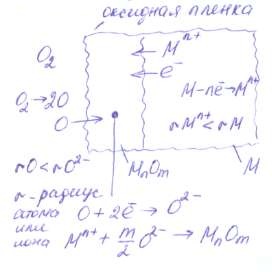
1) Если 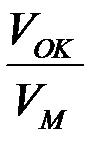 < 1, то пленка не может быть сплошной и защищать металл. Скорость роста пленки в этом случае постоянна:
< 1, то пленка не может быть сплошной и защищать металл. Скорость роста пленки в этом случае постоянна: 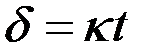 ; где
; где 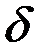 — толщина пленки;
— толщина пленки; 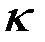 — const;
— const; 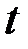 — время окисления. Такая зависимость характерна для щелочно - земельных металлов.
— время окисления. Такая зависимость характерна для щелочно - земельных металлов.
2) Если 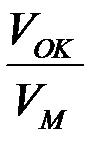 > 1, то чем толще пленка, тем меньше коррозия. Эта зависимость характерна для металлов Fe, Co, Ni, Mn, Ti. Кинетика окисления этих металлов имеем параболическую зависимость:
> 1, то чем толще пленка, тем меньше коррозия. Эта зависимость характерна для металлов Fe, Co, Ni, Mn, Ti. Кинетика окисления этих металлов имеем параболическую зависимость: 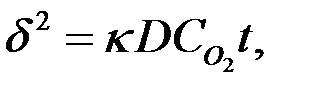 где
где
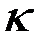 — const, D — коэффициент диффузионного тока; CO2 — концентрация кислорода в газе.
— const, D — коэффициент диффузионного тока; CO2 — концентрация кислорода в газе.
Для ряда металлов (Zn, Al, Cr) установлена логарифмическая зависимость роста пленки во времени:
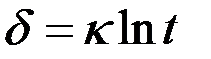 .
.
Пленки таких металлов обладают высокими защитными свойствами.
Чтобы пленка обладала защитными свойствами, она должна быть сплошной, достаточно тонкой, прочной, эластичной, иметь хорошее сцепление с металлом и одинаковый с ним коэффициент линейного расширения.
Скорость коррозии возрастает с увеличением температуры из-за повышения коэффициента диффузии. Быстрое разрушение пленки вызывают резкие колебания температуры, что связано с различными коэффициентами расширения металла и пленки.
ЭЛЕКТРИЧЕСКАЯ КОРРОЗИЯ. МЕХАНИЗМ
Коррозия металла в средах с ионной проводимостью протекает через анодное окисление металла:
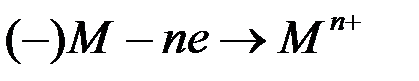 и катодное восстановление окислителя
и катодное восстановление окислителя 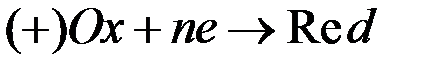 .
.
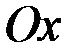 :
: 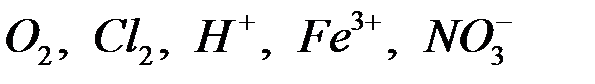 и др.
и др.
Коррозия с кислородной деполяризацией:
Чаще всего при 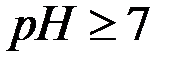 наблюдается восстановление кислорода:
наблюдается восстановление кислорода: 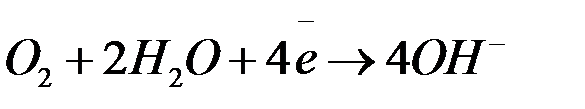
при 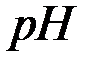 < 7 :
< 7 : 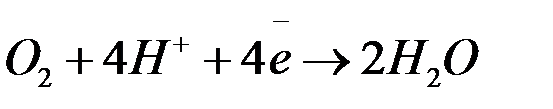
и выделения водорода: 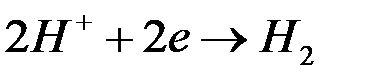 — коррозия с водородной деполяризацией.
— коррозия с водородной деполяризацией.

Основное отличие процессов электрохимической коррозии от процессов гальванического элемента — отсутствие внешней цепи. Электроны не входят из металла, а двигаются внутри него. Химическая энергия реакции не в виде работы, а в виде теплоты, которая рассеивается в окружающей среде.

