Уравнение скорости реакции, протекающей по законам формальной кинетики
2A+B=2C
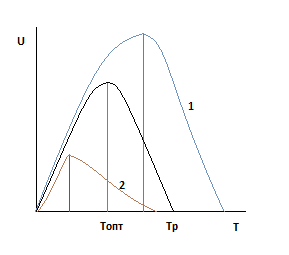
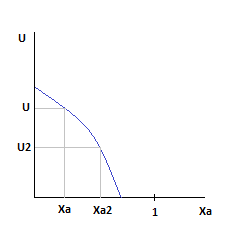
Давление и Ха постоянны.
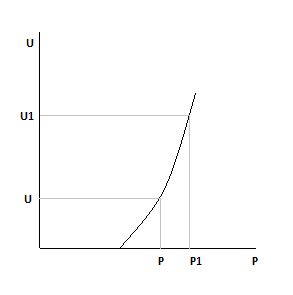
Как изменятся зависимости при:
1)Увеличим давление, Ха=const
2)Увеличим Xa, давление постоянно.
Чтобы проанализировать необходимо оценить влияние давления на скорость реакции для первого случая и влияние давления на оптимальную и равновесную температуры.
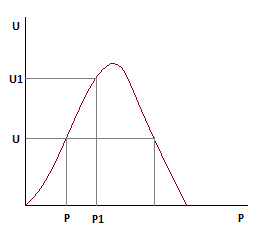
Очевидно, что во всем диапазоне изменения давления увеличение давления приводит и к увеличению скорости.
Выражения для расчета:
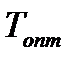 пропорциональна
пропорциональна 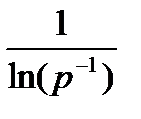
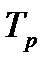 пропорциональна
пропорциональна 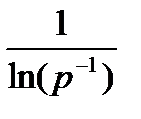
p-1=p2-3
С увеличением давления равновесная и оптимальная температуры растут.
Зависимость будет смещена относительно базовой.
Зависимость скорости от степени превращения ключевого компонента.
По мере роста Ха, скорость падает во всем диапазоне изменения степени превращения.
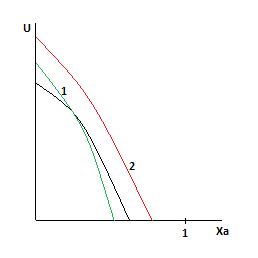 Анализ уравнения для расчета оптимальной и равновесной температур показывает, что с ростом Ха, оптимальная и равновесная температуры падают.
Анализ уравнения для расчета оптимальной и равновесной температур показывает, что с ростом Ха, оптимальная и равновесная температуры падают.
Развернем координатную сетку.
T,P=const
1.Увеличим T, P=const
2.Увеличим P, T=const
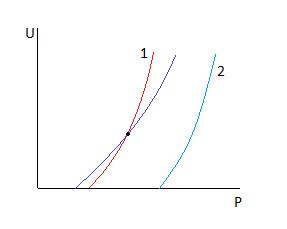
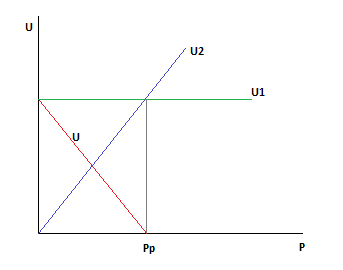
Рассмотрим точку пересечения.
До нее k резко растет, а движущая сила падает.
После неё движущая сила падает, а k растет, но скорость стремится к 0. 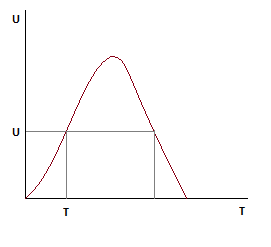
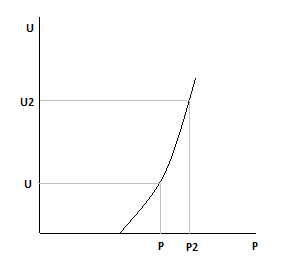
2) Увеличиваем давление, следовательно X*Ea тоже растет.
С увеличением давления скорость химической реакции растет.
Рассмотрим эндотермическую реакцию:
А=В+С
1) Давление растет при постоянной степени превращения;
2) Степень превращения растет при постоянном давлении.
Пересечение говорит о том, что есть температура, при которой скорость не зависит от давления.
Для увеличения скорости реакции необходимо увеличить давление в определенном диапазоне. В результате получаем зависимость с пересечением.
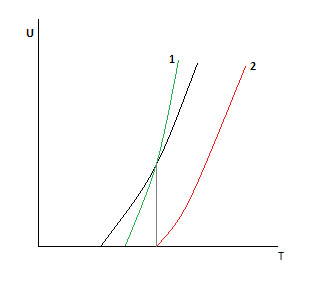
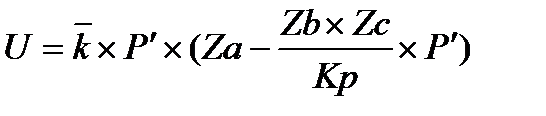
С увеличением давления выражение в скобках падает, таким образом получаем противоречие.
Задание1 Экзотермическая реакция.
2А+В=2С
1.Увеличиваем температуру, степень превращения постоянна.
2.Степень превращения растёт, температура постоянна.
Задание 2 Эндотермическая реакция.
A=B+C
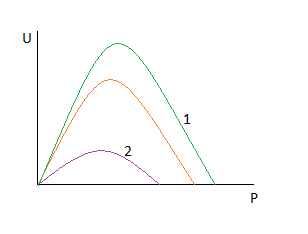
1.Увеличиваем температуру, степень превращения постоянна.
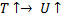
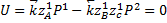
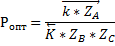
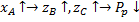
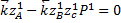
Функция проходит через максимум.
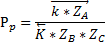
2.Увеличиваем степень превращения, температура постоянна.
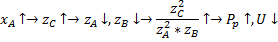
Реальные процессы
CH3OH↔CO+2H2
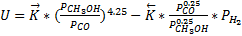
Это эмпирическое уравнение скорости реакции разложения метанола (имеет место в метанольных топливных элементах).
Такое уравнение для суммарной скорости реакции связано с тем, что СО адсорбируется на поверхности катализатора.
Проанализируем как будет зависеть скорость процесса от давления при постоянных температуре и степени превращения метанола.
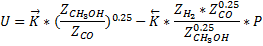
Степень превращения и температура постоянны. Вычитая из прямой скорости реакции обратную получим, что для данной реакции наблюдается уменьшение суммарной скорости реакции с ростом давления. То есть для данной реакции отсутствует понятие оптимальное давление, а любое увеличение давлении выше атмосферного приведёт к уменьшению суммарной скорости реакции.
