Координационное число и геометрия координационных соединений
Координационное число – основная характеристика комплексообразователя, показывающая количество донорных атомов, с помощью которых лиганды непосредственно связаны с центральным атомом. К. ч. для разных комплексов обычно варьируются от 2 до 12.
Комплексные соединения с к.ч. 2 известны для однозарядных ионов, таких как, Ag+, Cu+, Au+. Они имеют линейное строение, комплексообразователь находится в состоянии sp1-гибридизации, [2] например, [Cu(NH3)2]Cl или K[Ag(CN)2].
Комплексные соединения с координационным числом 3 встречаются редко. Комплексный ион имеет конфигурацию плоского треугольника с sp2‑гибридизацией центрального атома, например, K[Cu(CN)3].
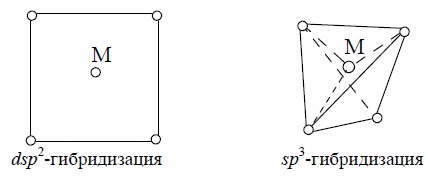
Комплексные соединения с координационным числом 4 достаточно хорошо изучены и могут иметь либо тетраэдрическое, либо плоскоквадратное строение [2]. Комплексообразователь в таких соединениях находится в состоянии dsp2-гибридизации (квадрат) и sp3-гибридизации (тетраэдр), например: [Pt(NH3)2Cl2] и K2[Zn(OH)4]:
Химия комплексных соединений с координационным числом 5 в настоящее время развивается бурными темпами. Особенно большое число таких комплексов получено для ионов Fe+2, Co+2, Ni+2. Их геометрической конфигурацией является тригональная бипирамида или тетрагональная пирамида. Во многих комплексах эти геометрические фигуры сильно искажены.
Наиболее распространены координационные соединения с монодентатными лигандами (L и X) типа: [ML3X2], [ML4X]+, [ML5]2+, где X – анионы, а L – молекулы P(CH3)3 или P(C6H5)3 (донорный атом – фосфор).
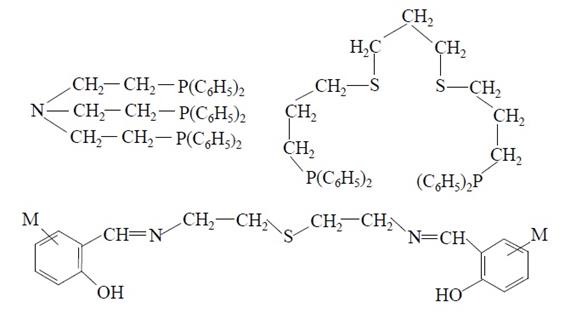
Тридентатные лиганды (L), входящие в состав полученных пятикоординированных комплексов [MLX2], содержат донорные атомы азота, фосфора и серы: Ph2P−CH2−CH2−S−CH2−CH2−PPh2, (CH3)2N−CH2−CH2−NH−CH2−CH2−N(CH3)2. [2] Известны комплексы Co+2, Ni+2 [MLX]+ с тетрадентатными лигандами: N(CH2−CH2−P(C6H5)2)3 и Ph2P−(CH2)3−S−(CH2)3−S−(CH2)3−PPh2, а также комплексы [ML]2+ с пентадентатными лигандами, [2] например:
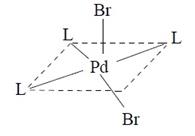
Форму искаженной тетрагональной пирамиды имеют такие комплексы [PdL3Br2], где лиганд L − 1,2-бис-(дифенилфосфиноэтан), 1,2-бис-(дифениларсиноэтан), 1,2-бис-(дифенилстибиноэтан):
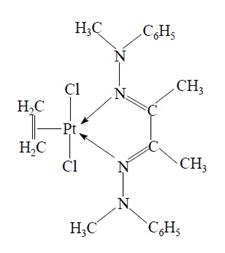
Тенденция к образованию пятикоординационных соединений увеличивается в ряду донорных атомов N − P − As − Sb [2]. Еще одним примером пятикоординационных комплексов являются этиленовые и ацетиленовые комплексы:
Как правило, в растворах пятикоординационные комплексные соединения типа [ML5]n+ с монодентатными лигандами имеют строение тригональной пирамиды.
Комплексные соединения с координационным числом 6 хорошо известны. Главным образом это комплексы с монодентатными лигандами. Такие комплексы имеют разное строение, в том числе и в форме октаэдра [2], например: [Fe(CN)6]3+, [Al(OH)6]3−, [Pt(TO)6]2+ (TO − тиоксан S(C2H4)O) или [Pt(ДЭС)4(TO)2]2+ (ДЭС – диэтилсульфид (C2H5)2S). Возможные формы полиэдров для комплексных соединений с координационным числом 6: а) плоский шестиугольник; б) тригональная призма; в) октаэдр:
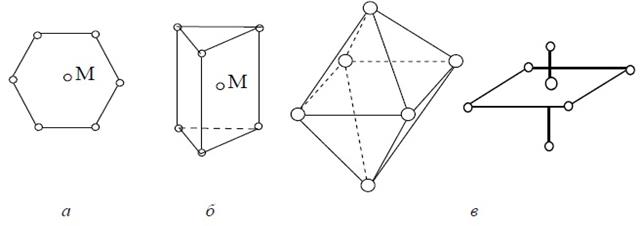
Существуют комплексные соединения и с большими координационными числами и с более сложными геометрическими формами [4].
