III. Реакции отщепления галогеноводорода
1. При нагревании
СH3-CH2Cl 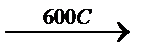 HCl + CH2=CH2
HCl + CH2=CH2
2. Под действием раствора щелочи
СH3-CH3-Cl + KOH=C2H5OH+KCl
Реакция нуклеофильного отщепления протекает по механизму ЕN2.
У третичных галоидных алкилов идет, в основном, по механизму ЕN1.
Подразделяются на три типа.
I. Галогенопроизводные винилового типа: атом галогена находится у непредельного атома углерода.
СН2=СНCl хлористый винил
СН2=ССl2 хлористый винилиден
СН2=С-ClСН=СН2 хлорпрен
II. Галогенпроизводные аллильного типа (галоген в 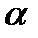 -положении к двойной связи).
-положении к двойной связи).
СН2=СН-СН2-Сl хлористый аллил
СН3-СН=СН-СН2Cl хлористый кротил
III. Галогенпроизводные с изолированным расположением двойной связи и Hal.
СН2=СН-СН2-СН2-Cl 4-хлор-1-бутен
В этом случае галоген не подвергается влиянию 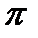 -связи и ведет себя так же, как в предельных галогеноводородах.
-связи и ведет себя так же, как в предельных галогеноводородах.
I. Галогенопроизводные винильного типа.
Получение
1) Присоединение одной молекулы ННal к ацетиленовым углеводородам.
СН  СН + HCl
СН + HCl 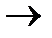 СН2=СНCl
СН2=СНCl
хлористый винил
2) Пиролиз полигалогенопроизводных
СН2Cl-СН2Cl 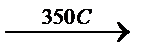 HCl + СН2=СН-Cl
HCl + СН2=СН-Cl
3) Действие недостатка спиртового раствора КОН на полигалогенопроизводные
Cl Cl
СНCl-СНCl 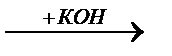 СНCl=CCl2
СНCl=CCl2
-HCl
ДИЕНОВЫЕ УГЛЕВОДОРОДЫ
Диеновыми углеводородами называются углеводороды открытого строения с двумя двойными связями. Общая формула СnH2n-2. В зависимости от расположения двойных связей они подразделяются на 3 вида:
1. Углеводороды с кумулированными связями (две двойные связи рядом).
| CH2=C=CH2 | аллен | 1, 2-пропадиен |
| CH3-CH=C=CH2 | метилаллен | 1, 2-бутадиен |
Эти соединения мало устойчивы и не имеют большого распространения.
2. Углеводороды с изолированными связями (две двойные связи, разделенные более чем одной простой), например:
| CH2=CH-CH2-CH=CH2 | 1, 4-пентадиен |
3. Углеводороды с сопряженными связями (две двойные связи, расположенные через одну простую):
| CH2=CH-CH=CH2 | дивинил | 1,3-пентадиен |
| CH2=C-CH=CH2 CH3 | изопрен | 2-метил-1,3-бутадиен |
Способы получения
Применяются общие методы введения двойной связи. Рассмотрим эти методы на примере получения наиболее важных диенов с использованием доступного сырья.
1. Дегидрирование предельных углеводородов или алкенов (метод Бызова), например:
СH3-CH2-CH2-CH3  H2+CH2=CH-CH2-CH3
H2+CH2=CH-CH2-CH3 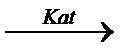 5500C H2+CH2=CH-CH=CH2
5500C H2+CH2=CH-CH=CH2
2. Получение бутадиена из этилового спирта (метод Лебедева):
CH2OH-CH3 + CH3-CH2OH 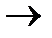 2H2O+H2+CH2=CH-CH=CH2
2H2O+H2+CH2=CH-CH=CH2
3. дегидрирование галогеналканов
СН2=СН-СН2-CI 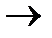 CН2=C=CН2
CН2=C=CН2
4. дегтдротация спиртовСН2=СН-СН2-ОН 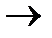 СН2=С=СН2+Н2О
СН2=С=СН2+Н2О
5. дегалогенирование дигалогеналканов
СН2=СCI-CH2CI+Zn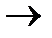 CН2=С=СН2
CН2=С=СН2
6. обработка спиртовым раствором дигалогеналканов
CCI-C-C-CCI+NaOH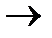 C=C-C=C
C=C-C=C
7. дегидротация спиртов
СОН-С-С-СОН+H2SO4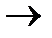 C=C-C=C+H2O
C=C-C=C+H2O
8. С=С-С С+Н2
С+Н2 С=С-С=С
С=С-С=С
Физические свойства
1.Диеновые углеводороды обладают более высокой температурой кипения, чем олефины:
1,3-бутадиен - +4,5оС; 1-бутен – 6,3оС.
2.Плотность их также выше, чем у олефинов, т.к. растет % содержания С: у пентена – 0,64 у пентадиена – 0,70.
3.Также выше показатель преломления (1,4 – 1,47 вместо 1,36 – 1,38 у этиленовых) – экзальтация МR.
2. Реакции окисления
Диены легко окисляются за счет активных двойных связей. Реакции идут так же, как у олефинов, за счет разрыва двойной связи.
1. Под действием озона:
СH2=CH-CH=CH2+2O3  CО2 +H2О +CH3-CО-CООН
CО2 +H2О +CH3-CО-CООН
2. Окисление молекулярным кислородом протекает:
а) с образованием перекисных олигомеров
CH2=CH-CH=CH2+ O2 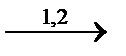 (-CH(CH CH2)-CH2-O-O-)n
(-CH(CH CH2)-CH2-O-O-)n 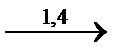 (-CH2-CH=CH-CH2-O-O-)n
(-CH2-CH=CH-CH2-O-O-)n
б) могут образовываться циклоперекисные продукты, здесь молекула кислорода работает как диенофил.
 | + O  O O |  |
3. Реакции полимеризации
Полимеризация диеновых углеводородов происходит в основном за счет 1,4-присоединения, хотя известны и 1,2-полимеры. Механизм реакций может быть ионным (металлические, металлорганические катализаторы) или свободно-радикальлным (в присутствии перекисного индикатора)
СH2=CH-CH=CH2 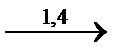 (-CH2-CH=CH-CH2-)n 1 тип
(-CH2-CH=CH-CH2-)n 1 тип
СH2=CH-CH=CH2 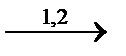 (-CH2-CH- )n
(-CH2-CH- )n
2 тип
CH2=CH2 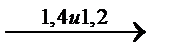 (-(CH2-CH=CH-CH2)x-(CH2-CH))n
(-(CH2-CH=CH-CH2)x-(CH2-CH))n
3 тип
III тип полимеризации наблюдается при использовании щелочных металлов в качестве катализатора. I и II тип полимеризации наблюдается при использовании катализатора Циглера.
Пространственная структура полимеров, полученная в присутствии катализатора Циглера, отличается регулярностью повторения однотипных звеньев, такие полимеры называются стереорегулярными. При этом наблюдается несколько видов стереоизомерии. 1,4-стереорегулярные полимеры могут иметь цис- или транс-строение.
