Физические свойства галогенов
МОДУЛЬНАЯ ПРОГРАММА
ГАЛОГЕНЫ
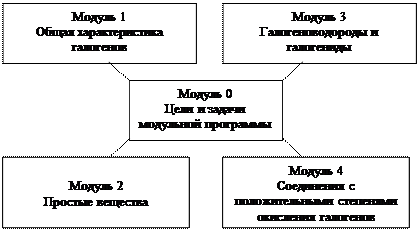
МОДУЛЬ 0
ЦЕЛИ И ЗАДАЧИ МОДУЛЬНОЙ ПРОГРАММЫ
Изучив данную программу, студент должен знать:
- особенности электронного строения атомов галогенов,
- важнейшие степени окисления галогенов,
- валентность атомов галогенов в ковалентных соединениях,
- изменение в группе галогенов атомных характеристик (атомный радиус, энергия ионизации, сродство к электрону, электроотрицательность),
- нахождение в природе,
- физические и химические свойства простых веществ,
- получение и свойства соединений галогенов со степенью окисления –1,
- получение и свойства соединений галогенов с положительными степенями окисления.
Изучив данную программу, студент должен уметь:
- выявлять и объяснять закономерности в изменении свойств простых веществ и важнейших соединений галогенов,
- проводить лабораторные опыты по получению и изучению свойств хлора, брома, йода и важнейших соединений галогенов.
МОДУЛЬ 1
ОБЩАЯ ХАРАКТЕРИСТИКА ГАЛОГЕНОВ (Hal)
УЭ-0. Цели и задачи модуля.
Изучив данный модуль, студент должен знать:
- электронное строение атомов галогенов, особенности строения атома фтора,
- степени окисления и валентные состояния атомов Hal,
- закономерности изменения в группе галогенов следующих свойств атомов:
- радиус атома,
- энергия ионизации,
- сродство к электрону,
- относительная электроотрицательность,
- нахождение галогенов в природе.
Изучив данный модуль, студент должен уметь:
- объяснять закономерности изменения атомных характеристик в группе галогенов,
- давать общую характеристику соединениям галогенов, исходя из степеней окисления атомов.
УЭ-1. Вводный контроль.
Задание 1. Изобразить электронно-графические формулы внешнего электронного уровня атомов галогенов. Чем принципиально отличается электронное строение атома фтора? Что такое кайносимметрия?
УЭ-2. Степени окисления и валентность атомов галогенов.
Задание 2. Напротив каждой степени окисления в таблице 1 напишите формулы соответствующих соединений.
Таблица 1
Степени окисления галогенов
| F | Cl | Br | I | ||||
| Степень окисления | Пример | Степень окисления | Пример | Степень окисления | Пример | Степень окисления | Пример |
| +7 | +7 | +7 | |||||
| –1 | +6 | +6 | +6 | ||||
| +5 | +5 | +5 | |||||
| +4 | +4 | +4 | |||||
| +3 | +3 | +3 | |||||
| +2 | +2 | +2 | |||||
| +1 | +1 | +1 | |||||
| –1 | –1 | –1 |
Почему у фтора нет положительных степеней окисления?
Задание 3. Валентность элемента определяется числом валентных орбиталей и числом валентных электронов. Чему равна максимально возможная валентность фтора? Сколько валентных орбиталей имеет атом хлора? Какова максимальная валентность хлора в известных соединениях?
УЭ-3. Атомные характеристики галогенов.
Задание 4. Постройте график зависимости rков(Hal) = f(z). Объясните наблюдающуюся закономерность.
Таблица 2
Степени окисления галогенов
| Элемент | rков., нм | I1, эВ | Е, эВ | ОЭ | dHal-Hal, нм | DНсв., кДж/моль | Ткип., °С | 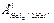 В В |
| F | 0,071 | 17,42 | 3,34 | 4,0 | 0,142 | 78,00 | –187 | 2,87 |
| Cl | 0,099 | 13,01 | 3,61 | 3,0 | 0,199 | 121,30 | –34,2 | 1,359 |
| Br | 0,114 | 11,24 | 3,36 | 2,8 | 0,228 | 111,80 | 58,75 | 1,065 |
| I | 0,133 | 10,45 | 3,06 | 2,5 | 0,267 | 106,84 | 184,5 субл | 0,536 |
Задание 5. Сродство к электрону хлора (Е) выше, чем у фтора. Как это объяснить?
Задание 6. По данным таблицы 2 сделайте вывод об изменении атомных характеристик в группе галогенов.
УЭ-4. Галогены в природе.
Задание 7. Одним из законов геохимии является утверждение, что элементы с четными атомными номерами имеют большее распространение в природе, чем элементы с нечетными номерами. Проверьте это правило, сравнив распространенность р-элементов VI и VII групп.
Таблица 3
Распространенность в природе р-элементов VI и VII групп
| Элемент | Содержание в земной коре, масс. % | Элемент | Содержание в земной коре, масс. % |
| O | 47,4 | F | 9,5∙10–2 |
| S | 2,6∙10–2 | Cl | 1,3∙10–2 |
| Se | 5∙10–6 | Br | 3,7∙10–5 |
| Te | 5∙10–7 | I | 1,4∙10–5 |
| Po | следы | At | следы |
Задание 8. За исключением вулканических газов в природе встречаются только соединения галогенов. Предложите гипотезу образования хлора в недрах вулкана.
МОДУЛЬ 2
ПРОСТЫЕ ВЕЩЕСТВА
УЭ-0. Цели и задачи модуля.
Изучив данный модуль, студент должен знать:
- лабораторные методы получения галогенов,
- важнейшие физические свойства галогенов,
- важнейшие химические свойства галогенов.
Изучив данный модуль, студент должен уметь:
- получать в лаборатории Cl2, Br2 и I2.
- проводить лабораторные опыты по изучению свойств хлора, йода, хлорной, бромной и йодной воды.
УЭ-1. Вводный контроль.
Задание 1. Сравните стандартные окислительно-восстановительные потенциалы галогенов (таблица 2). Какие из галогенов можно получить, используя стандартный раствор перманганата калия (  = 1,507 В)? Почему для получения газообразного хлора используют кристаллический KMnO4?
= 1,507 В)? Почему для получения газообразного хлора используют кристаллический KMnO4?
УЭ-2. Получение галогенов.
Опыт 1. (Тяга!) Получение хлора.
В колбу Вюрца поместить около 10 г KMnO4. Из капельной воронки добавлять по каплям концентрированную соляную кислоту. Выделяющийся газ после пропускания через промывные склянки с насыщенным раствором NaCl и концентрированной H2SO4 (с какой целью?) собрать в большие пробирки. После заполнения (определяется по цвету) пробирки закрыть пробками.
Опыт 2. (Тяга!) Получение брома и йода. В сухую пробирку поместить несколько кристаллов KBr и MnO2. Добавить 2-3 капли конц. H2SO4 и немного подогреть. Повторить опыт, используя вместо бромида йодид калия.
УЭ-3. Свойства галогенов.
Задание 1. Заполните таблицу 3.
Таблица 3
Физические свойства галогенов
| Галоген | Агрегатное состояние при комнатной температуре | Цвет | Отношение к нагреванию |
| F2 | |||
| Cl2 | |||
| Br2 | |||
| I2 |
Опыт 3. (Тяга!) Возгонка йода.
В сухую пробирку поместить 2-3 кристаллика йода. Осторожно нагреть. Повторить опыт, закрыв пробирку ватным тампоном. Сравнить результаты опытов. Дать объяснения.
Опыт 4. (Тяга!) Получение хлорной воды.
Опустить газоотводную трубку с выделяющимся хлором (опыт 1) в стакан с водой. Насыщать воду хлором в течение 10 минут. Отметить цвет и запах (проверять осторожно) полученной хлорной воды.
Опыт 5. (Тяга!) Получение раствора гипохлорита натрия.
Опустить газоотводную трубку с выделяющимся хлором (опыт 1) в стакан с холодным раствором NaOH. Насыщать раствор хлором в течение 10 минут. Полученный раствор сохранить для последующих опытов.
Опыт 6. (Тяга!) Получение бертолетовой соли.
Опустить газоотводную трубку с выделяющимся хлором (опыт 1) в стакан с горячим раствором КOH. Насыщать раствор хлором в течение 10 минут. Полученный раствор охладить. Объяснить выпадение кристаллов.
Опыт 7. (Тяга!) Растворимость йода в воде, растворе KI и органических растворителях.
1-2 кристаллика йода поместить в пробирки с 1-2 мл различных растворителей. Взболтать. Результаты наблюдений занести в таблицу 4.
Таблица 4
