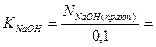ЛАБОРАТОРНАЯ РАБОТА № 2. "Определение карбонатной жесткости воды."
"Определение карбонатной жесткости воды."
Жесткость воды обусловлена присутствием растворенных солей кальция и магния. Различают два вида жесткости: карбонатную и некарбонатную.
Карбонатная (временная) жесткость зависит от содержания в воде гидрокарбонатов кальция и магния. Она почти полностью устраняется при длительном кипячении. При этом гидрокарбонат кальция разлагается и осаждается карбонат кальция:
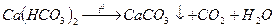
Гидрокарбонат магния при этом также разлагается, но образующийся карбонат магния заметно растворяется в воде ( 0,1 г в 1л).
Некарбонатная (постоянная) жесткость обусловлена присутствием хлоридов и сульфатов кальция и магния, которые при кипячении остаются в растворе.
По существующим стандартам жесткость воды определяется в миллимоль эквивалентах растворенных солей кальция и магния в 1 л воды, (ммоль/л).
Методика определения
В основе определения лежат реакции:
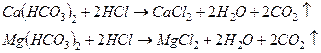
Для определения отбирают мерной колбой 100 мл исследуемой воды, добавляют 2-3 капли метилового оранжевого и титруют 0,1н. раствором HCl до изменения окраcки индикатора от желтого до оранжевого цвета. Точное титрование повторяют еще 2-3 раза. Из 3-х сходящихся результатов (разность не более 0,1 мл) берут среднее.
Данные эксперимента:
КHCl =______
NHCl = ______моль/л
VH2O =______мл

Водопроводная вода
V1 HCl =______мл
 V2 HCl =______мл
V2 HCl =______мл
 V3 HCl =______мл
V3 HCl =______мл
VCp. HCl =______мл
Кипяченая вода
V1 HCl =______мл
 V2 HCl =______мл
V2 HCl =______мл
 V3 HCl =______мл
V3 HCl =______мл
VCp. HCl =______мл
Обработка результатов:
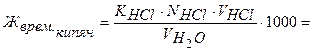 ммоль-экв/л Са2+ и Mg2+.
ммоль-экв/л Са2+ и Mg2+.
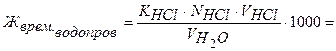 ммоль-экв/л Са2+ и Mg2+.
ммоль-экв/л Са2+ и Mg2+.
ЛАБОРАТОРНАЯ РАБОТА № 3
"Установка титра приготовленного раствора NаОН по стандартизированному (установленному) раствору HCl"
В основе установки титра лежит следующая реакция
HCl + NaOH = NaCl + H2O
Рабочим раствором является стандартизированный 0,1н раствор. НСl.
Методика определения
В колбу для титрования емкостью 100 мл отмеривают пипеткой 10 мл 0,1 н. рабочего раствора соляной кислоты, приливают 1-2 капли раствора фенолфталеина (индикатор) и титруют из бюретки раствором NаOH до появления бледно-розовой окраски, не исчезающую в течение 2-х минут. Точное титрование повторяют еще 2-3 раза. Из 3-х сходящихся результатов (разность не более 0,1 мл) берут среднее.
Данные эксперимента:
К HCl = _______
N HCl = ________моль/л
V NaOH = ______мл
V1 HCl =______мл
 V2 HCl =______мл
V2 HCl =______мл  VCp. HCl =_______мл
VCp. HCl =_______мл
 V3 HCl =______мл
V3 HCl =______мл
Обработка результатов:
Рассчитайте практическое значение молярной концентрации эквивалентов раствора гидроксида натрия, используя закон эквивалентов для растворов нормальной концентрации (“золотое” правило аналитики).
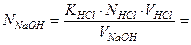


2) Рассчитайте титр раствора гидроксида натрия.
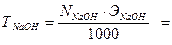
3) Рассчитайте поправочный коэффициент 0,1 н раствора гидроксида натрия.