Методические рекомендации. Химические реакции осуществляются для получения необходимых веществ или энергии за
Химические реакции осуществляются для получения необходимых веществ или энергии за счет их проведения. Рассмотрение реальности протекания химического процесса следует проводить с двух позиций энергетической и кинетической. Сначала необходимо оценить, возможна ли вообще данная реакция в заданных условиях. Анализ энергетических соотношений показывает, что самопроизвольно протекают процессы в сторону наиболее вероятного состояния систем. В частности в результате таких процессов энергия выделяется, и система переходит в состояние с меньшей энергией.
Скорость химической реакции определяется как изменение концентрации веществ в единицу времени и в единице объема
V= 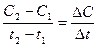
где, V -скорость химической реакции
∆C - изменение концентрации веществ
∆t - время, за которое произошло изменение концентрации
Скорость химической реакции зависит от концентрации, температуры,
давления, катализатора.
Зависимость скорости химической реакции от концентрации выражается законом действующих масс: скорость химической реакции пропорциональна произведению концентраций реагирующих веществ, возведенных в степени их стехиометрических коэффициентов. Этот закон выражается кинетическим уравнением.
v = k CA ∙ СB
где, СА и Св - молярные концентрации веществ А и В, a k - коэффициент пропорциональности, называемый константой скорости.
Зависимость скорости реакции от температуры определяется правилом Вант-Гоффа, согласно которому при повышении температуры на каждые 10 градусов скорость большинства реакций увеличивается в 2 -4 раза.
Математически эта зависимость выражается соотношением
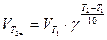
где, VT1 VT2скорости реакции соответственно при начальной (T1) и конечной (T2) температурах, а γ - температурный коэффициент скорости реакции, который показывает, во сколько раз увеличивается скорость реакции с повышением температуры на каждые 100.
Сильное изменение скорости реакции с изменением температуры объясняет теория активации.
Скорость реакции часто зависит от присутствия катализатора. Катализатор - это вещество, изменяющее скорость реакции и остающееся после нее химически неизменным,
Химические реакции, протекающие в присутствии катализатора, называются каталитическими. Различают гомогенный (однородный) и гетерогенный (неоднородный) катализ.
Химическое равновесие - это такое состояние системы реагирующих веществ, при котором скорости противоположных реакций равны.
При равновесии V1 = V2
Например, I2 + Н2 = 2НI
где, V1 - скорость прямой реакции,
V2 - скорость обратной реакции
k1[I2]∙[HI] = k2[HI]2 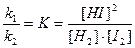
где, К - константа химического равновесия
Смешение равновесия в зависимости от изменения концентраций реагирующих веществ, температуры, давления (в случае газовых реакций) определяется принципом Ле- Шателье.
Если на систему, находящуюся в равновесии, производится какое-либо внешнее воздействие (изменение С, t0, P), то оно благоприятствует протеканию той из двух противоположных реакций, которая ослабляет воздействие.
Увеличение концентрации исходных веществ благоприятствует протеканию прямой реакции и, следовательно, равновесие сместится вправо. Увеличение концентрации продуктов реакции вызовет смещение равновесия влево.
Реакции могут идти с выделением теплоты (экзотермические) или с поглощением (эндотермические). С повышением температуры идет та реакция, которая поглощает эту теплоту - эндотермическая, а с понижением температуры - экзотермическая.
Чтобы определить влияние давления на смещение равновесия, необходимо подсчитать число молекул в левой и правой частях уравнения. Если же в уравнении число молекул в левой части равно числу молекул в правой части, например N2 + О2 = 2NO то изменение давления не вызовет смещения химического равновесия.
Оборудование и реактивы: секундомер, три бюретки, штатив с пробирками. Дистиллированная вода, три стакана на 200-250 мл, термометр. Растворы: тиосульфат натрия, серная кислота, хлорид железа, роданид калия, разбавленные растворы хлорида железа и роданиды калия. Кристаллическая соль: хлорид калия.
