Характеристика элементов по классам, исходя из электронной конфигурации атома
Характеристика элемента включает определение его свойств (металл или неметалл), валентностей, степеней окисления, составление основных классов соединений, исходя из степени окисления элемента.
Характеристика s-элемента, на примере магния
Mg+12 1s2 2s2 2p6 3s2 валентные электроны
| ¯ | 3p |
3s Строение валентных электонов (нормальное состояние – с.о.= 0)
Mg – металл (так как число валентных электронов £ 2)
При взаимодействии с квантами поля атомы легко переходят в возбужденное состояние, при этом происходит перескок электрона в пределах своего энергетического уровня:
Mg* возбужденное состояние
| | |||
| | 3p |
3s
По числу неспаренных электронов определяют валентность т. е. число химических связей атома с другими атомами. Она, как правило, соответствует степени окисления (с.о.)
с.о.=+2 (равна валентности или числу неспаренных электронов)
Mg+2O ® Mg2+(OH)-2 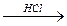 Mg2+Cl-2
Mg2+Cl-2
оксид Mg гидроксид Mg хлорид Mg
Характеристика р элемента, на примере серы
S+16 1s2 2s2 2p6 3s2 3p4 валентные электроны
| 3S | ¯ | | |
| ¯ | 3p |
Строение валентных электонов (нормальное состояние – с.о.= 0).
S – неметалл (число валентных электронов ³ 4). По числу неспаренных электронов можно определить валентность II. Ей соответствует с.о.= +2 (неустойчива) и с.о.= -2, например, в соединении H2S.
S* возбужденное состояние
| | ||||||||
| | | | 3d | |||||
| ¯ | 3p |
3s
с.о.= +4 (равна валентности или числу неспаренных электронов)
 S+4O2 H2SO3
S+4O2 H2SO3 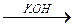 K2SO3
K2SO3
оксид S(IV) сернистая кислота сульфит калия
S**второе возбужденное состояние
| | | |||||||
| | | | 3d | |||||
| | 3p |
3s
с.о.= +6 (равна валентности или числу неспаренных электронов)
 S+6O3 H2SO4
S+6O3 H2SO4 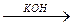 K2SO4
K2SO4
оксид S(VI) серная кислота сульфат калия
Характеристика р элемента, на примере алюминия
Al+13 1s2 2s2 2p6 3s2 3p1
валентные электроны
| | |||
| ¯ | 3P | 3 |
3s Строение валентных электонов (нормальное состояние – с.о.= 0).
Al – амфотерный металл (амфотерность чаще проявляется для атомов с числом валентных электронов равным 3 или 4 ). По числу неспаренных электронов можно определить с.о.=+1, однако для элементов III группы главной подгруппы с.о.= +1 неустойчива.
Al* возбужденное состояние
| | | ||
| | 3p |
3s с.о.=+3 (равна валентности)
 Al+3 2O3® Al3+(OH)-3
Al+3 2O3® Al3+(OH)-3 
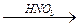 Al(NO3)3
Al(NO3)3
амф.оксид Al гидроксид Al нитрат алюминия
HAlO2 
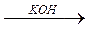 KAlO2
KAlO2
метаалюминевая кислота метаалюминат калия
Амфотерные свойства характерны также и для р-элементов с большим радиусом атома. Это Ge, As, Sn, Sb, Te, Pb, Bi, Po.
Характеристика d элемента, на примере железа
Fe+26 1s2 2s2 2p6 3s2 3p6 3d6 4s2 валентные электроны
| ¯ | |||||||||
| ¯ | | | | | 4s | ||||
3d
Строение валентных электрнов (нормальное состояние – с.о.= 0).
Fe – металл (так как число валентных электронов на внешнем уровне £2)
Fe* возбужденное состояние
| | |||||||||
| | 4p | p | |||||||
| ¯ | | | | | 4s | ||||
3d
Данная модель представления о строении валентных электронов позволяет для d семейства элементов определить только максимальную и минимальную степень окисления в возбужденном состоянии.
min с.о.=+2 ( количество неспаренных электронов на внешнем уровне)
max c.o.=+6 (общее количество неспаренных валентных электронов )
 Fe+2O Fe2+(OH)-2
Fe+2O Fe2+(OH)-2 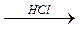 Fe2+Cl-2
Fe2+Cl-2
оксид Fe(II) гидроксид Fe(II) хлорид Fe(II)
В высшей степени окисления, когда частица теряет ³ 4 (в нашем случае 6 электронов), изменяется энергия связи оставшихся валентных электронов и ядра, уменьшается радиус частицы. Поэтому в высших степенях окисления оксиды и гидроксиды d-элементов проявляют кислотные свойства.
 Fe+6O3 H2 FeO4
Fe+6O3 H2 FeO4 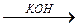 K2 FeO4
K2 FeO4
оксид Fe(VI) железная кислота феррат калия
Рекомендуемая литература: [1], с. 37-96; [2], с.17-34.
