Строение метильного радикала
Метильный радикал построен следующим образом. Свободный атом углерода имеет четыре валентных электрона. Если три из четырех электронов образуют электронные пары трёх s-связей с тремя атомами водорода, то образуется семиэлектронная оболочка атома углерода метильного радикала:
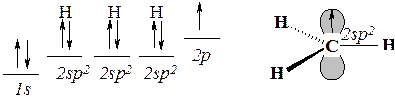
Один из электронов атома углерода оказывается неспаренным. В свободном радикале он занимает р-орбиталь. Трехвалентный углерод метильного радикала находится в sр2-гибридном состоянии. Три s-связи располагаются в одной плоскости, перпендикулярной оси р(p)-орбитали, и образуют углы 120о .
Расчет изменения энергии в ходе реакции
Взаимодействие метана с другими галогенами протекает по такому же механизму. Легкость взаимодействия (реакционная способность) убывает в следующем ряду: F2 > CI2 > Вr2 > I2. Иодирование алканов практически неосуществимо.
Что значит сравнить реакционную способность реагентов по отношению к одному и тому же органическому соединению? Если мы говорим, что хлор более реакционноспособен, чем бром по отношению к метану, то это означает следующее: скорость взаимодействия хлора с метаном больше, чем скорость взаимодействия брома с метаном в одинаковых условиях (концентрация реагентов, температура).
От чего зависит скорость, а следовательно, реакционная способность? Для того чтобы ответить на этот вопрос, рассмотрим подробнее, как протекают реакции (2) и (3), в ходе которых образуется продукт – хлорметан.
В свободнорадикальных процессах, протекающих без участия заряженных частиц, фактором, определяющим легкость протекания реакции, является различие в энергии разрываемых и образующихся связей. В стадии продолжения цепи (реакция 2) расходуется 427·103 Дж/моль на разрыв связи С–Н в метане, и выделяется 431·103 Дж/моль при образовании молекулы H–CI
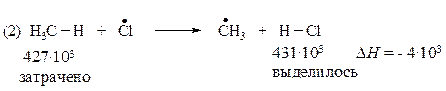
Следовательно, реакция (2) слабо экзотермична. Она протекает с тепловым эффектом минус 4·103 Дж/моль.
В третьей стадии на разрыв связи CI–CI требуется затратить 243·103 Дж/моль. Выделяющаяся при образовании связи C–CI энергия составляет 339·103 Дж/моль. Тепловой эффект реакции равен минус 96·103 Дж/моль
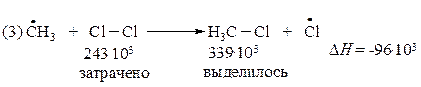
Таким образом, реакция (3) более экзотермична, чем реакция (2).
Проведем подобный расчет для реакций продолжения цепи (2) и (3) бромирования метана:
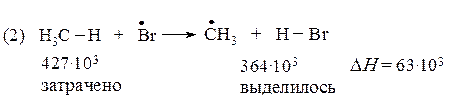
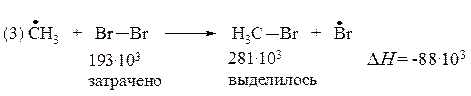
Реакция (2) является эндотермической, а реакция (3) - экзотермической, т.е. протекает с выделением тепла. Экзотермическая реакция протекает достаточно быстро, в то время как эндотермическая - очень медленно.
Энергетическая диаграмма реакции. Связь энергии
