Методы определения координационного числа
Существует большое количество разнообразных методов определения координационного числа комплексообразователя в координационных соединениях. Так, как было уже отмечено ранее, еще Вернер [3] предсказывал к.ч. и строение координационного соединения, изучая изомерию соединений. Однако такой "химический" метод имеет существенные ограничения, поэтому в настоящее время используются для этих целей более строгие методы, основанные на изучении либо физических, в том числе, спектральных свойств координационных соединений, либо количественного исследования процессов комплексообразования в растворах. Наибольшее распространение получили два таких метода: метод молярных отношений (метод насыщения) и метод изомолярных серий (метод непрерывных изменений).
Определения состава комплекса методом изомолярных серий (метод непрерывных изменений)
Метод основан на определении зависимости какой-либо физической характеристики раствора (оптическая плотность, интенсивность люминесценции и др.) от отношения молярных концентраций реагирующих веществ (иона-комплексообразователя и лиганда) в изомолярных растворах, т.е. растворах, в которых сумма концентраций реагирующих веществ сохраняется постоянной.
Такая кривая зависимости физической величины от состава раствора характеризуется экстремальной точкой (рис. 1) [1, 8], отвечающей максимальному выходу образующегося комплексного соединения MemRn.
Такая точка отвечает максимально возможной концентрацией комплекса MemRn, образующегося по реакции mMe + nR ↔ MemRn, а ее положение (абсцисса) однозначно связано со стехиометрическими коэффициентами m и n. Для выполнения анализа приготовляют растворы обоих компонентов одинаковой молярной концентрации и смешивают их в антибатных соотношениях от 0 : 10 до 10 : 0, сохраняя неизменным общий объем раствора (VМе + VR = V = const) при оптимальных значениях рН. При этом суммарное число молей обоих компонентов в общем объеме смеси всегда остается постоянным СМе+CR=C=const.
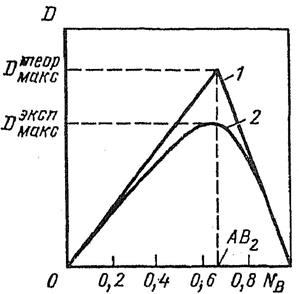
Рисунок 1 – Зависимость оптической плотности D изомолярных растворов от мольной доли лигандов NB при образовании комплекса состава АВ2 [8]:
1 – теоретическая кривая; 2 – экспериментальная кривая
Определение состава комплекса методом молярных отношений (метод насыщения)
Сущность метода заключается в установлении зависимости какой-либо физической характеристики раствора от концентрации реагента (СR) при постоянной концентрации металла (СМе) или наоборот. Пример зависимости физической величины от CR/CМе при постоянной концентрации СМе (кривая насыщения) изображена на рис. 2 [1]. Точка пересечения касательных к начальному и конечному участку кривой соответствует точке эквивалентности (т.э. – на рис.), которая для процесса комплексообразования определяет отношение количества лиганда к количеству комплексообразователя, т.е. координационное число комплексообразователя в образуемом комплексе.
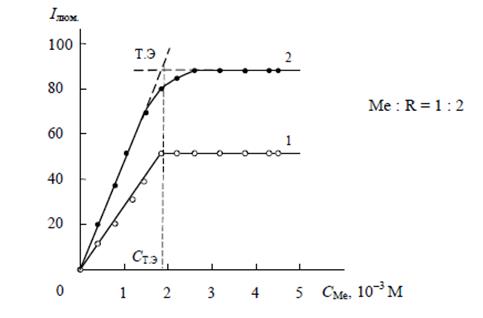
Рис. 4 – Метод молярных отношений (кривая насыщения) [1]: 1 – для прочного комплекса, 2 – для малопрочного комплекса, требующего достаточный избыток реагента
Экспериментальная часть
Эксперимент проводился на базе оборудования школьной лаборатории "Муниципальное казенное общеобразовательное учреждение "Средняя общеобразовательная школа" с. Владимиро-Александровское", приобретенного за счет средств ЗАО "Восточная нефтехимическая компания", и лабораторий кафедры химических и ресурсосберегающих технологий ШЕН ДВФУ.
Оборудование
Взвешивание образцов проводили на весах Vibra AJH-420CE (Япония) и ГОСМЕТР с точностью до 0.001 г.
Фотометрирование растворов проводили на спектрофотометре КФК-3-ЗОМЗ и однолучевом спектрофотометре Unico 1200.
Исходные растворы
2.2.1 Раствор комплексообразователя Cu2+
Навеску медного купороса CuSO4×5H2O массой 24.958 г (0.100 моль) поместили в мерную колбу объемом 1 л, растворили в 500 мл дистиллированной воды и довели дистиллированной водой до метки.
C(Cu2+) = m(CuSO4)×1000/[M(CuSO4)×V]
C(Cu2+) = 24.958×1000/[249,58×1000] = 0.100 моль/л
2.2.2 Раствор лиганда NH3
Продажный раствор аммиака объемом 7.5 мл с концентрацией ~25 моль/л внесли в мерную колбу объемом 1 л и довели дистиллированной водой до метки.
m0(р-ра) = V0×r0
Плотность указанного раствора аммиака×r0 .в соответствии со справочными данными [7] равна 0.907 г/мл.
m0(р-ра) = 7.5×0.907 » 6.8 г
Масса аммиака в этом растворе:
m(NH3) = m0(р-ра)×w/100 = 6.8×25/100 = 1.7 г
Тогда, концентрация аммиака:
C(NH3) = m(NH3)×1000/M×V
C(NH3) = 1.7×1000/17×1000 » 0.1 моль/л
Т.к. исходная концентрация аммиака в продажном реактиве известна неточно и отбор объема V0 проводился при помощи мерного цилиндра, концентрация полученного раствора определена лишь приблизительно. Определение точной концентрации раствора аммиака проводили методом обратного титрования (см. п. 2.2.2.3). Для этого были приготовлены 0.1 н. растворы серной кислоты и щелочи (см. п.п. 2.2.2.1 и 2.2.2.2, соответственно).
