Окислительно-восстановительное равновесие
1. ЭЛЕКТРОДНЫМ ПОТЕНЦИАЛОМ СОГЛАСНО ТЕРМИНОЛОГИИ ИЮПАК ЯВЛЯЕТСЯ
1) потенциал полуреакции, записанной в форме реакции окисления
2) потенциал полуреакции, записанной в форме реакции восстановления
3) потенциал, возникающий в ячейке в смеси двух Red/Ox систем при а=1 для всех ионов
2. ПОЛОЖИТЕЛЬНЫЙ ЗНАК ЭЛЕКТРОДНОГО ПОТЕНЦИАЛА УКАЗЫВАЕТ
1) на сильные окислительные свойства (Ох)
2) на сильные восстановительные свойства (Red)
3) восстановление Ох-формы протекает самопроизвольно по отношению к стандартному водородному электроду
4) не происходит самопроизвольного восстановления Ох- формы по отношению к стандартному водородному электроду
3. ИЗМЕНЕНИЕ ТЕМПЕРАТУРЫ ДЛЯ ПОТЕНЦИАЛА ОБРАТИМОЙ Red/Ox ПАРЫ УЧИТЫВАЕТСЯ
1) подстановкой соответствующего значения температуры в уравнение Нернста для данной Red/Ox пары и для стандартного водородного электрода
2) введением поправки на температуру только в уравнение Нернста Red/Ox пары, а значение Е стандартного водородного электрода принимается постоянным для любых температур
3) температура не влияет на значение ЕRed/Ox
4. ЭЛЕКТРОЛИТИЧЕСКАЯ ЯЧЕЙКА ЭТО
1) ячейка, являющаяся источником электрической энергии
2) ячейка, для работы которой требуется внешний источник
энергии
3) любая ячейка, в которой протекают окислительно-
восстановительные реакции
5. ЭЛЕКТРОХИМИЧЕСКИ ОБРАТИМОЙ ЯВЛЯЕТСЯ ЯЧЕЙКА
1) в которой изменение направления тока вызывает протекание иных реакций на одном или на обоих электродах
2) в которой направление химических реакций на электродах меняется в зависимости от величины тока и времени
3) в которой изменение направления тока приводит к изменению химических реакций на электродах
6. ОТРИЦАТЕЛЬНОЕ ЗНАЧЕНИЕ ΔЕ УКАЗЫВАЕТ НА ТО, ЧТО РЕАКЦИЯ
1) не может самопроизвольно протекать в прямом направлении
2) протекает самопроизвольно в прямом направлении
3) протекает очень медленно
4) обратима
7. ОБЛАСТЬЮ ИСПОЛЬЗОВАНИЯ УРАВНЕНИЯ НЕРНСТА ЯВЛЯЕТСЯ
1) можно использовать для всех окислительно- восстановительных систем
2) можно использовать только для обратимых окислительно- восстановительных систем
8. СОВПАДЕНИЕ ИЗМЕРЕННОГО ПОТЕНЦИАЛА ПОЛУРЕАКЦИИ С ВЫЧИСЛЕННЫМ ПО ФОРМУЛЕ НЕРНСТА УКАЗЫВАЕТ НА ТО, ЧТО
1) оксилительно-восстановительная реакция протекает очень
быстро
2) система термодинамически обратима
3) окислительно-восстановительная реакция протекает очень
медленно
4) разность потенциалов полуреакции (Е°) имеет большое численное значение
5) разность потенциалов полуреакции (Е°) имеет отрицательное значение
9. ВОДОРОДНЫЙ ЭЛЕКТРОД МОЖЕТ ВЫПОЛНЯТЬ СЛЕДУЮЩИЕ ФУНКЦИИ
1) только функции анода
2) только функции катода
3) функции анода или катода в зависимости от того, какой полуэлемент находится в паре с ним
10. УВЕЛИЧИТЬ ОКИСЛИТЕЛЬНУЮ СПОСОБНОСТЬ Red/Ox ПАРЫ МОЖНО
1) связав окисленную форму в малорастворимое или комплексное соединение
2) связав восстановленную форму в малорастворимое или комплексное соединение
11. УВЕЛИЧИТЬ ВОССТАНОВИТЕЛЬНУЮ СПОСОБНОСТЬ Red/Ox ПАРЫ МОЖНО
1) связав восстановленную форму в малорастворимое или комплексное соединение
2) связав окисленную форму в малорастворимое или комплексное соединение
| 12. ПОТЕНЦИАЛ | Red/Ox | ПАРЫ | ПРИ СВЯЗЫВАНИИ |
| ВОССТАНОВЛЕННОЙ | ФОРМЫ | В | МАЛОРАСТВОРИМОЕ |
СОЕДИНЕНИЕ ИЗМЕНИТСЯ ПО СЛЕДУЮЩЕМУ УРАВНЕНИЮ
1) Ox+nē Red E01
2) Ox+nē + ARedA↓ E02
3) E20- E10= 0,059/n lg1/ПР
4) E20- E10= 0,059/n lg1/ПР
5) E20- E10= 0,059/n lgПР
13. ВОССТАНОВИТЕЛЬНАЯ СПОСОБНОСТЬ СЕРЕБРА БУДЕТ МАКСИМАЛЬНОЙ В РАСТВОРЕ, СОДЕРЖАЩЕЙ
1) азотную кислоту
2) соляную кислоту
3) йодистоводородную кислоту
14. УКАЖИТЕ ФОРМУЛУ СТАНДАРТНОГО ПОТЕНЦИАЛА ДЛЯ ПОЛУРЕАКЦИИ AgClтв+ē → Agтв+ Cl-
1) E0=E0Ag+/Ag + 0,059 lg1/ПР
2) E0=E0Ag+/Ag + 0,059 lgПР
3) E0=E0Ag+/Ag + 0,059 lg(1/ПР)
15. ДОБАВЛЕНИЕ 2M H2SO4
МАКСИМАЛЬНО ИЗМЕНИТ
ЗНАЧЕНИЕ Е ПРИ СТАНДАРТНЫХ ЗНАЧЕНИЯХ АКТИВНОСТИ
Red/Ox ФОРМ В СЛУЧАЕ
1) MnO4-, 8H+/Mn2+
2) H3AsO4, 2H+/HAsO2 3) Cr2O72-, 14H+/2Cr3+4) I2/ 2I-
16. Е° СИСТЕМЫ Cr2O72-/2Cr3+БУДЕТ НАИБОЛЕЕ БЛИЗОК К Е° ПРИ aox=ared=1 В СРЕДЕ
1) рН =7
2) 1М HСl
3) pH= 1
4) pH 10
5) 1M H2SO4
17. ДАНЫ Red/Ox СИСТЕМЫ. ПОЛУРЕАКЦИЯ Fe2++ē→Fe3+(E°=0,77B) ПОЙДЕТ В ПРЯМОМ НАПРАВЛЕНИИ В СЛУЧАЕ:
1) I2/2I-, E0=0,62 B
2) Br2/2Br-, E0=1,06 B
3) MnO4-/Mn2+, E0=1,51B
4) Ag+/Ag , Eº=0,799B
5) Cr2O72-/2Cr3+, Eº=1,33B
18. ОЦЕНИТЕ СИЛУ ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНОЙ СПОСОБНОСТИ ДВУХ ПАР, ЕСЛИ ИМЕЕТ МЕСТО ВЗАИМОДЕЙСТВИЕ Ox1+Red2↔Red1+Ox2
1) Ox1 < Ox2, Red2>Red1
2) Ox1 > Ox2, Red1>Red2
3) Ox1 < Ox2, Red1<Red2
4) Ox1 > Ox2, Red1<Red2
19. ПОТЕНЦИАЛ СЕРЕБРЯНОГО ЭЛЕКТРОДА В РАСТВОРЕ, НАСЫЩЕННОМ ХЛОРИДОМ СЕРЕБРА, ЕСЛИ
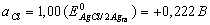 БУДЕТ РАВЕН
БУДЕТ РАВЕН
1) +0,799 В
2) +1,998 В
3) +0,222 В
20. РЕАКЦИЯ 2Fe3++ 2I-=2Fe2++ I2НАИБОЛЕЕ ПОЛНО ПОЙДЕТ В ОБРАТНОМ НАПРАВЛЕНИИ (Е° I2/2I-= 0,62 B) В СЛУЧАЕ
1) Fe3+/Fe2+(E0=0,77B)
2) Fe3+/Fe2+в присутствии ЭДТА (Е=0,143)
3) Fe3+/Fe2+в присутствии 1,10 фенантролина (Е=1,19B)
4) Fe3+/Fe2+в присутствии KCN (E=0,36B)
21. СКОРОСТЬ ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНОЙ РЕАКЦИИ ЗАВИСИТ ОТ ВЕЛИЧИНЫ КОНСТАНТЫ РАВНОВЕСИЯ
1) да
2) да, если константа равновесия больше 104
3) нет, если константа равновесия меньше 10
4) нет
22. БОЛЬШОЕ ЧИСЛЕННОЕ ЗНАЧЕНИЕ КОНСТАНТЫ РАВНОВЕСИЯ ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНОЙ РЕАКЦИИ УКАЗЫВАЕТ НА ТО, ЧТО
1) равновесие смещено вправо и реакция идет практически до конца
2) равновесие смещено влево и реакция идет практически до конца
3) реакция протекает очень быстро
4) реакция протекает очень медленно
23. СТЕПЕНЬ ОКИСЛЕНИЯ ЭТО
1) формальный заряд, который приобрел бы атом элементарного объекта, если бы все химические связи были бы ковалентными
2) число двухэлектронных связей, которые имеет атом в данном элементарном объекте
3) формальный заряд, который приобрел бы атом элементарного объекта, если бы все химические связи, за исключением неполярных ковалентных связей, были бы ионными связями. (элементарный объект - молекула, ион, формульная единица)
24. ИЗ ПРИВЕДЕННЫХ ОКИСЛИТЕЛЕЙ СПОСОБЕН ОКИСЛЯТЬ В КИСЛОЙ, НЕЙТРАЛЬНОЙ И ЩЕЛОЧНОЙ СРЕДАХ СЛЕДУЮЩИЙ
1) K2Cr2O7
2) K2CrO4
3) KNO3
4) H2O2
5) KMnO4
25. ПРОДУКТОМ ВОССТАНОВЛЕНИЯ MnO4-В НЕЙТРАЛЬНОЙ ИЛИ СЛАБО КИСЛОЙ СРЕДАХ ЯВЛЯЕТСЯ
1) Mn2+
2) Mn3+
3) MnO(OH)2
26. ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫМИ НАЗЫВАЮТСЯ РЕАКЦИИ
1) с изменением окраски
2) сизменением степени окисления
3) сизменением pH
4) сизменением растворимости
27. ДЛЯ ОЦЕНКИ ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНОЙ СПОСОБНОСТИ СЛУЖИТ
1) потенциал ионизации
2) электродный потенциал
3) энергия электронных переходов
4) константы диссоциации
28. ВЕЛИЧИНА
E 0 = -DG 0 / nF НАЗЫВАЕТСЯ
1) стандартным электродным потенциалом
2) кинетической энергией системы
3) термодинамической константой электрода
4) полной энергией системы
29. РАВНОВЕСНЫЙ ПОТЕНЦИАЛ ПОЛУРЕАКЦИЙ ПРИ АКТИВНОСТЯХ ВСЕХ УЧАСТВУЮЩИХ В РАВНОВЕСИИ ЕДИНИЦЕ РАВНЫХ 1М НАЗЫВАЕТСЯ
1) стандартным равновесным потенциалом
2) гальваническим потенциалом
3) концентрационным потенциалом
4) стандартным электродным потенциалом
30.
|
 Ox
Ox
Re d
|
 Ox
Ox
Re d
+ 0.059 lg
 n
n
g Oxa Ox
 g Re d a Re d
g Re d a Re d
- ЭТО
1) стандартный электродный потенциал
2) формальный электродный потенциал
3) равновесный электродный потенциал
4) концентрационный электродный потенциал
31. ФОРМАЛЬНЫЙ ПОТЕНЦИАЛ НЕ ЗАВИСИТ ОТ
| 1) | ионной силы | |
| 2) | глубины протекания конкурирующей реакции | |
| 3) | концентрации частиц, не являющихся окисленной | или |
восстановленной формами, но принимающих участие в полуреакции
4) материала электрода
32. УРАВНЕНИЕ НЕРНСТА, ПРЕДСТАВЛЕННОЕ В ВИДЕ
E = E 0
+ 0.059 lg[H+ ] + 0.059 lg [Ox]
 Ox
Ox
Re d
Ox
Re d
n [Re d ]

|
1) влияние на потенциал образования малорастворимых соединений
2) влияние комплексообразования
3) влияние t
4) влияние pH
33. ЭЛЕКТРОЛИТИЧЕСКАЯ ЯЧЕЙКА, В КОТОРОЙ РЕАКЦИЯ ПРОТЕКАЕТ САМОПРОИЗВОЛЬНО, НАЗЫВАЕТСЯ
1) гальваническим элементом
2) электролизёром
3) аккумулятором
4) батареей
34. СТАНДАРТНЫЙ ЭЛЕКТРОД, ОТВЕЧАЮЩИЙ ТРЕБОВАНИЯМ ОБРАТИМОСТИ, ПОСТОЯНСТВА ПОТЕНЦИАЛА И ЕГО ВОСПРОИЗВОДИМОСТИ,- ЭТО
1) хлоридсеребряный электрод
2) стеклянный электрод
3) водородный электрод
4) хингидронный электрод
35. 
 ГАЛЬВАНИЧЕСКИЙ ЭЛЕМЕНТ ДАНИЭЛЯ – ЯКОБИ ИМЕЕТ ВИД
ГАЛЬВАНИЧЕСКИЙ ЭЛЕМЕНТ ДАНИЭЛЯ – ЯКОБИ ИМЕЕТ ВИД
1) H 2
, Pt H +
Zn 2+ Zn
2)  Zn Zn 2+
Zn Zn 2+
Cu 2+ Cu
3) 




 Pt, H 2 HCl, AgCl(нас.) Ag;
Pt, H 2 HCl, AgCl(нас.) Ag;
4)  Pt Fe3+, Fe2+
Pt Fe3+, Fe2+
Ag + Ag.
36. СИСТЕМА, СОСТОЯЩАЯ ИЗ ОКИСЛЕННОЙ И ВОССТАНОВЛЕННОЙ ФОРМ ДАННОГО ВЕЩЕСТВА НАЗЫВАЕТСЯ
1) окисленной формой
2) восстановленной формой
3) редокс-парой
4) ОВР
37. ЭФФЕКТИВНОСТЬ ОКИСЛИТЕЛЬНЫХ И ВОССТАНОВИТЕЛЬНЫХ СВОЙСТВ ДАННОГО ВЕЩЕСТВА ОПРЕДЕЛЯЕТСЯ
1) величиной электродного потенциала редокс-пары
2) количеством отданных электронов
3) условиями протекания реакции
4) электродвижущей силой системы
38. ВОЗМОЖНОСТЬ ОПРЕДЕЛЕНИЯ ТЭ ПРИ ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНОМ ТИТРОВАНИИ ЗАВИСИТ О ТВЕЛИЧИНЫ
1) ПР
2) рН
3) ЭДС
4) [ox]/[red]
39. СПЕЦИФИЧЕСКИМ ИНДИКАТОРОМ, ПРИМЕНЯЕМЫМ В РЯДЕ МЕТОДОВ ОКИСЛЕНИЯ-ВОССТАНОВЛЕНИЯ ЯВЛЯЕТСЯ
1) фенилантраниловая кислота
2) крахмал
3) дифениламин
4) ферроин
40. ВЕЩЕСТВА, КОТОРЫЕ В ОДНИХ РЕАКЦИЯХ МОГУТ БЫТЬ ВОССТАНОВИТЕЛЯМИ, А В ДРУГИХ – ОКИСЛИТЕЛЯМИ, В ЗАВИСИМОСТИ ОТ ПРИРОДЫ ПАРТНЕРА – РЕАГЕНТА И
УСЛОВИЙ ПРОТЕКАНИЯ ОКИСЛИТЕЛЬНО– ВОССТАНОВИТЕЛЬНОЙ РЕАКЦИИ, НАЗЫВАЮТСЯ
1) окисителями
2) редокс-парой
3) редокс-амфотерными
4) восстановителями
41. ЯВЛЯЕТСЯ ЛИ СТАНДАРТНЫЙ ВОДОРОДНЫЙ ЭЛЕКТРОД ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫМ
1) нет
2) да
3) в зависимости от электрода сравнения
4) в зависимости от редокс-пары
42. ГЛУБИНА ПРОТЕКАНИЯ ОКИСЛИТЕЛЬНО- ВОССТАНОВИТЕЛЬНЫХ РЕАКЦИЙ ОПРЕДЕЛЯЕТСЯ
1) величиной формальных окислительно-восстановительных потенциалов системы
2) разностью относительных окислительно-восстановительных потенциалов реакции
3) величиной условного окислительно-восстановительного потенциала системы
4) разностью стандартных окислительно-восстановительных потенциалов редокс-пар, участвующих в реакции
