Определение активности амилазы (сывороточная амилаза крови)
Принцип метода. Показателем активности фермента является убыль крахмала, расщепляемого под действием сывороточной амилазы.
Для построения стандартной кривой в 5 мерных колбочек емкостью 50 мл наливают по 30–40 мл воды, переносят по 0,5; 1.0; 2,0; 3,0; 4,0 мл раствора крахмала, добавляют по 0,5 мл раствора соляной кислоты, по 0,1 мл раствора йода, доводят водой до метки и перемешивают. Колориметрируют через 5 мин на ФЭКе с красным светофильтром относительно воды в кюветах с расстоянием 1 см между рабочими гранями.
Ход работы. В 2 центрифужные пробирки наливают по 0,5 смеси растворов крахмала и хлорида натрия и по 0,3 мл фосфатной буферной смеси. В пробирку 1 (опыт) добавляют 0,1 мл сыворотки крови, в пробирку 2 (контроль) – 0,1 мл дистиллированной воды. Обе пробирки инкубируются в термостате (37 °С) в течение 30 мин. Затем в обе пробирки добавляют по 0,1 мл 1 н. раствора соляной кислоты и центрифугируют в течение 10 мин при 1500 об/мин. В мерные колбы (50 мл) наливают по 30–40 мл воды, переносят по 0,2 мл центрифугата и проводят цветную реакцию, как это описано для построения стандартной кривой.
Активность амилазы (Е) выражают количеством крахмала (мг), которое может расщепить за 30 мин фермент, содержащийся в 100 мл сыворотки. Расчет ведут по формуле:
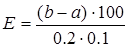 , (11)
, (11)
где Е – активность амилазы;
а – количество крахмала в опытной пробирке, найденное по стандартной кривой, мг;
b – количество крахмала в контрольной пробирке, найденное по стандартной кривой, мг;
100 – пересчет на 100 мл сыворотки;
0,1 –количество сыворотки, взятое для исследования, мл;
0,2 – количество центрифугата , взятое для цветной реакции, мл.
Материалы и реактивы. 1 %–ный раствор крахмала; 0,5 М раствор хлорида натрия; смесь 1 %–ного раствора крахмала с 0,5 М раствором хлорида натрия (4:1); фосфатный буфер, рН 7,2; сыворотка крови свежая без признаков гемолиза; 1 н. раствор соляной кислоты; 0,3 %–ный раствор йода в 3 %–ном растворе иодистого калия (см. Приложение 1, п. 2).
Оборудование. Штатив с центрифужными пробирками; пипетки; микропипетки (0,1 мл); термостат (37 °С); центрифуга; мерные колбы (50 мл); фотоэлектроколориметр.
Протеазы
Протеазы или протеолитические ферменты – это группа ферментов, относящаяся к классу гидролаз и подклассу пептид–гидролаз.
Пептид–гидролазы – ускоряют гидролиз пептидных связей в белках и пептидах.
В зависимости от характера действия протеазы делятся на протеиназы и пептидазы.
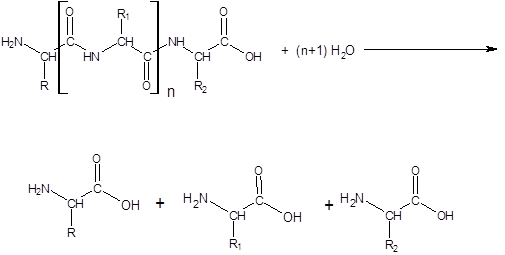 |
Протеиназы катализируют гидролиз небольшого числа внутренних пептидных связей в белковой молекуле (эндопептидазы), с образованием пептидов.
Пептидазы катализируют гидролиз пептидных связей в пептидах с образованием свободных аминокислот (экзопептидазы). Пептидазы могут отщеплять от пептида аминокислоту, имеющую свободную аминогруппу (¾NН2) – это аминопептидазы, либо аминокислоту, имеющую свободную карбоксильную группу (¾СООН) –карбоксипептидазы.
Очень важной особенностью протеаз является выборочный (селективный) характер их действия на пептидные связи в белковой молекуле. Так, пепсин избирательно ускоряет гидролиз пептидных связей, образованных аминокислотами Фен и Лей; трипсин – Арг и Лиз; химотрипсин – ароматическими аминокислотами Фен, Трп, Тир; папаин – Арг, Лиз, Фен и т. д. (см. рисунок5)
Причина избирательного действия пептид–гидролаз заключается в том, что радикал аминокислоты, по соседству с которым гидролизуется пептидная связь, служит для образования фермент–субстратного комплекса.
Механизм действия пептидгидролаз рассмотрен на примере действия химотрипсина (см. рисунок 6).
Фрагменты единой полипептидной цепи молекулы фермента условно показаны слева и справа изогнутой линией, в их составе отмечены остатки сер и гис с их функциональными группами. В активном центре фермента точно против остатковсер и гис размещается пептидная связь гидролизуемого белка, образованная остаткомфен (или
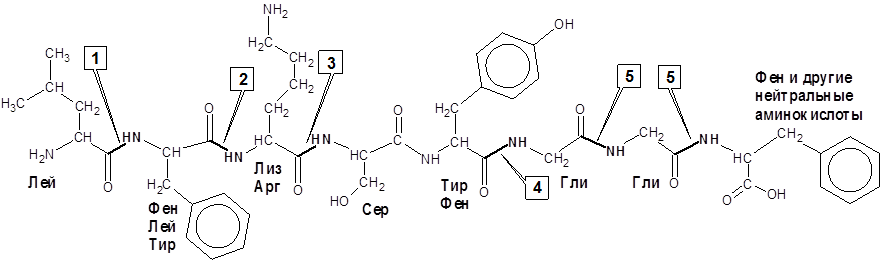
1 – лейцинаминопептидаза
2 – пепсин
3 – трипсин
4 – химотрипсин
5 – карбоксипептидаза А
Рисунок 5 – Точки приложения действия протеолитических ферментов на пептидные связи
в белковой молекуле
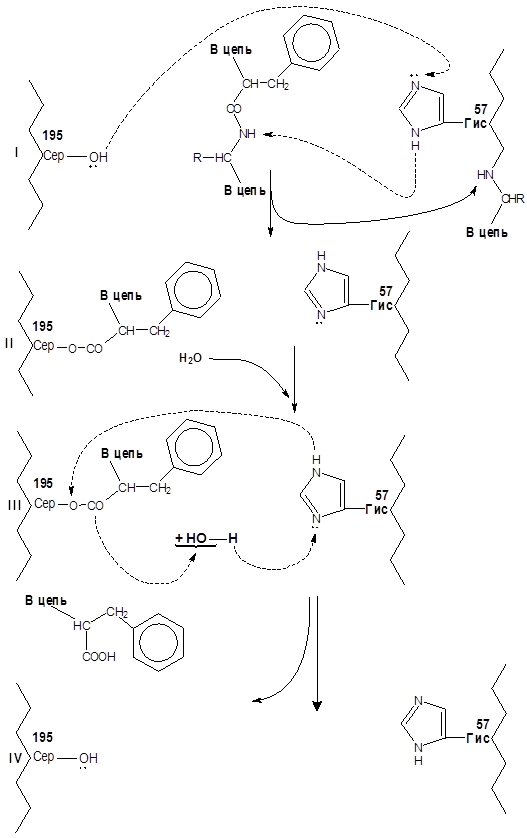 |
Рисунок 6 – Упрощенная схема гидролиза пептидной связи
в активном центре химотрипсина
тир, три, лей), благодаря контакту радикалафен (или тир, три, лей) с субстратным центром, фермента, который на рисунке не показан. Вследствие того, что электронная пара кислорода гидроксильной группы радикаласеракцептируется карбонильной группой пептидной связи, создаются условия для миграции протона от гидроксиласер к имидазольному радикалу остаткагис для ацилирования радикаласер с одновременным разрывом пептидной связи. Одновременно протон от имидазольного ядра радикалагис перемещается к NН – групп деструктируемой пептидной связи (I). После ацилирования радикаласер (II) в активный центр фермента входит молекула воды, инициирующая распад ацильного производного фермента (III) и восстановлении исходного состояния активного центра (IV), готового принять новую молекулу субстрата или атаковать пептидную связь, образованную остаткамифен, тир, три илилей в том же субстрате.
Ферментативный гидролиз белков находит практическое использование при определении первичной структуры белков, для регуляции обмена веществ, т.к. многие продукты селективного гидролиза белков обладают высочайшей биологической активностью: именно этим путем из проферментов образуются ферменты, из предшественников гормонов – гормоны и рилизинг – факторы.
Важным этапом технологии многих пищевых производств являются биохимические превращения белков, происходящие под действием протеолитических ферментов. Повышенная активность протеаз наблюдается в прорастающем зерне пшеницы, ржи, что приводит к снижению хлебопекарных достоинств муки из такого зерна. На пивоваренных заводах ячмень проращивают с целью накопления ферментов, в том числе и протеолитических, для осуществления гидролиза белковых веществ при приготовлении пивного сусла.
Протеолитические ферменты входят в состав ферментных препаратов грибного и растительного происхождения, широко применяемы для интенсификации технологических процессов производства различных пищевых продуктов и улучшения их качества.
