Сравнение эффективности реакторов идеального смешения и идеального вытеснения в изотермическом режиме
При одинаковых условиях проведения одной и той же реакции для достижения равной глубины превращения среднее время пребывания реагентов в проточном реакторе идеального смешения больше, чем в реакторе идеального вытеснения. Этот факт может быть легко объяснён характером распределения концентрации реагентов по объёму указанных реакторов. Если в проточном реакторе идеального смешения концентрации во всех точках равны конечной концентрации( линия 1), то в реакторе идеального вытеснения в двух соседних точках на оси реактора концентрации реагентов уже отличаются (линия 2). Например, в случае реакции первого порядка формула распределения концентрации реагента А по длине реактора идеального вытеснения будет иметь вид
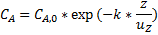
Скорость реакции, согласно закону действующих масс, пропорциональна концентрации реагентов. Следовательно, в РИВ она всегда выше, чем в проточном РПС. А при большей скорости протекания реакции для достижения той же глубины превращения требуется меньшее время пребывания реагентов в реакторе.
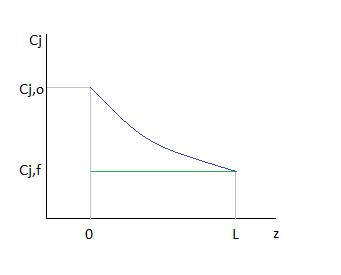
Более наглядно можно проиллюстрировать, сравнивая среднее время пребывания реагентов в проточных реакторах как площади геометрических фигур.
Сравним эффективность работы идеальных проточных реакторов для случая проведения в них простых реакций, не осложненных побочными взаимодействиями. Зададимся одинаковой степенью превращения исходного реагента и будем считать более эффективным тот реактор, в котором для достижения заданных результатов требуется меньшее среднее время пребывания 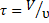
Для проточного РПС при заданной глубине превращения среднее время пребывания можно определить как произведение двух постоянных величин:
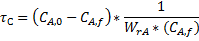
или
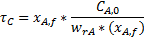
То есть геометрически представить в виде прямоугольника с соответствующими сторонами.
Для стационарного режима идеального вытеснения:
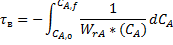
Или
r wsp:rsidR="00000000"><w:pgSz w:w="12240" w:h="15840"/><w:pgMar w:top="1134" w:right="850" w:bottom="1134" w:left="1701" w:header="720" w:footer="720" w:gutter="0"/><w:cols w:space="720"/></w:sectPr></w:body></w:wordDocument>"> 
То есть величина 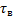 как определённый интеграл выражается геометрически площадью криволинейной трапеции.
как определённый интеграл выражается геометрически площадью криволинейной трапеции.
Площади криволинейных трапеций, соответствующие 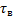 , меньше площадей прямоугольников, соответствующих
, меньше площадей прямоугольников, соответствующих 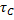 , причём разница тем больше, чем больше достигаемая в реакторе степень превращения исходного реагента. Следовательно, при равном объёмном расходе для достижения одинаковых результатов реактор идеального вытеснения должен иметь меньший объём, чем проточный реактор смешения. Интенсивность работы реактора идеального вытеснения
, причём разница тем больше, чем больше достигаемая в реакторе степень превращения исходного реагента. Следовательно, при равном объёмном расходе для достижения одинаковых результатов реактор идеального вытеснения должен иметь меньший объём, чем проточный реактор смешения. Интенсивность работы реактора идеального вытеснения
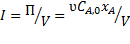
будет выше. Объяснить это можно более высокой скоростью реакции в реакторе вытеснения вследствие более высокой концентрации реагентов.
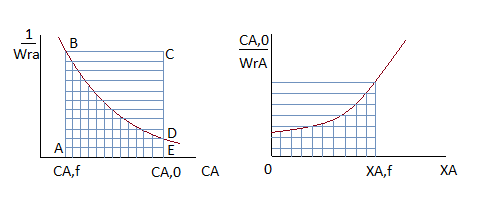
Однако не всегда стремятся к поддержанию более высоких концентраций исходных реагентов. При проведении параллельных реакций разного порядка в том случае, если порядок целевой реакции меньше порядка побочной реакции при низких концентрациях исходных реагентов обеспечиваются более высокие значения дифференциальной селективности. Если порядок целевой реакции превышает порядок побочной параллельной реакции, выход целевого продукта выше в РИВ. При этом и среднее время пребывания для достижения заданной степени превращения реагентов меньше, чем в РПС.
Если порядок целевой реакции меньше порядка побочной реакции, более высокое значение выхода целевого продукта достигается в РПС. Однако в рассматриваемом случае, то есть при одинаковой степени превращения исходного реагента, среднее время пребывания в реакторе идеального смешения больше, чем в РИВ.
Если целевая и побочная реакции имеют одинаковый порядок, выход целевого продукта при равной степени превращения исходного реагента не зависит от типа выбранного реактора.
Для достижения высокого выхода целевого продукта эффективнее РИВ, а иногда РПС. При этом следует отметить, что даже при достижении более высокого выхода целевого продукта при равной степени превращения РПС имеет больший объём, чем РИВ.
Задание 3 Обратимая реакция.
А=С+2D
Эндотермическая обратимая реакция.
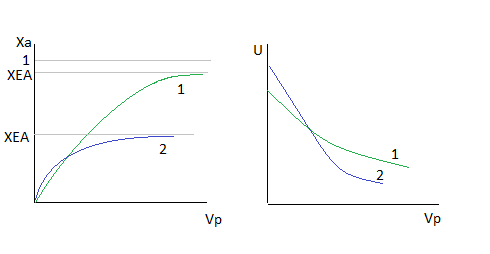
1. 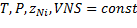
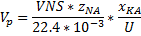
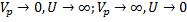
2. 
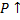
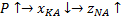
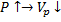
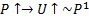
Задание 4 Необратимая эндотермическая реакция.
2A=C+D
1. 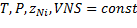
2. 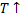
Задание 5 Реакция без изменения объёма.
Увеличение давления для такой реакции не влияет на её скорость.
