Влияние избытка осадителя на полноту осаждения
Введение в раствор избытка одноименных ионов влечет за собой дополнительное выпадение осадка. Это явление очень широко используется в аналитической практике. Качественно наблюдаемый эффект можно объяснить смещением равновесия в системе осадок Û раствор. Например, при введении избытка ионов Cl- в систему: AgCl↓ Û Ag+ + Cl- + Cl-избыток
равновесие смещается в сторону образования AgCl и наблюдается более полное связывание ионов серебра. Количественный расчет приведен в решении задачи 2 §7. Введение избытка осаждающего иона противопоказано, если образующийся осадок амфотерен или вступает с ионом осадителем в последующее взаимодействие с образованием комплексных соединений. Например:
а) при сливании растворов нитрата ртути (II) и иодида калия сначала образуется иодид ртути, осадок красного цвета:
Hg(NO3)2 + 2KJ = HgJ2↓ + 2KNO3
который при дальнейшем введении иодида калия растворяется
HgJ2↓ + 2KJ = K2[HgJ4]
с образованием комплексной соли тетраиодомеркурат (II) калия;
б) при осаждении ионов Са2+ сульфатом аммония идет растворение осадка CaSO4 с образованием комплексной соли:
Са2+ + SO42- Û CaSO4↓;
CaSO4 + (NH4)2SO4 = (NH4)2[Ca(SO4)2];
в) при осаждении ионов Al3+ гидроксид-ионами следует избегать избытка осаждающих ионов, т.к. идет процесс растворения Al(OH)3
Al3+ + 3OH- ↔ Al(OH)3↓
Al(OH)3↓ + 4OH- + 2H2O = [Al(OH)4(H2O)2] ;
г) при осаждении раствором аммиака катионов Cu2+, Ag+ и некоторых других осадки гидроксидов образуют с избытком раствора аммиака хорошо растворимые аммиакаты [Cu(NH3)4]Cl2, [Ag(NH3)2]Cl. Это явление используют при переведении в раствор осадка AgCl, нерастворимого в кислотах.
Таким образом, на практике следует учитывать возможность последующего взаимодействия осадка с избытком вводимого иона. Даже в тех случаях, когда такого взаимодействия нет, большого избытка ионов осадителя следует избегать по причине увеличения при этом ионной силы раствора и, соответственно, растворимости. Рассмотрим это на примере.
Пусть KtAn – малорастворимый бинарный электролит (AgCl, FeS, PbS и т.д.). Для осаждения катионов вводится избыток анионов, концентрация которых [An-]изб., произведение растворимости соли равно: 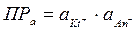 ;
; 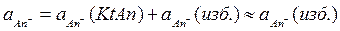 ,
,
т.к. 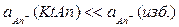 , и можно записать:
, и можно записать: 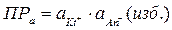 ;
;
подставим в это выражение значения 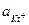 и
и 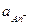 , равные соответственно:
, равные соответственно:
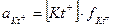 ;
; 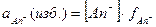 ; [Kt+] = Р моль/л;
; [Kt+] = Р моль/л;
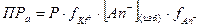 (V.3)
(V.3)
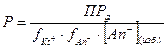 (V.4)
(V.4)
Из этой формулы (V.4) видно, что увеличение концентрации анионов [An-] способствует уменьшению растворимости осадка, но одновременно, при значительном увеличении концентрации ионов в растворе, увеличивается ионная сила раствора, уменьшаются коэффициенты активности и растворимость должна увеличиваться.
Учет факторов, влияющих на растворимость осадков, дает возможность осуществлять выбор условий наиболее полного осаждения того или иного соединения или его переведения в раствор.
