Кислотой Льюиса является частица
1) образующая при диссоциации ион H+ ;
2) имеющая неспаренный электрон;
3) способная принимать электронную пару;
4) обладающая повышенной электронной плотностью
Основанием Льюиса является частица
1) образующая при диссоциации ион OH-;
2) обладающая свободной электронной орбиталью для образования ковалентной связи;
3) способная отдавать электронную пару для образования ковалентной связи;
4) обладающая повышенной подвижностью в водных растворах
Основанием Бренстеда является частица
1) обладающая пониженной подвижностью в растворах;
2) способная присоединять протон;
3) имеющая свободную орбиталь;
4) образующая при диссоциации ион OH-
18. Математическая форма закона разведения Оствальда имеет вид:
1) 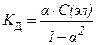 2)
2) 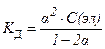 3)
3) 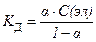 4)
4) 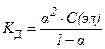
19. Понятию «константа диссоциации» соответствует определение:
1) отношение числа распавшихся молекул к общему числу молекул в растворе; 2) отношение числа продиссоциировавших молекул к числу молекул, не подвергшихся диссоциации;
3) отношение концентраций ионов, образовавшихся в результате диссоциации, к концентрации недиссоциированной части молекул;
4) стехиометрическое отношение произведения концентраций ионов, образовавшихся в результате диссоциации, к концентрации недиссоциированной части электролита
Понятию «степень диссоциации» соответствует определение
1) стехиометрическое отношение концентраций образовавшихся ионов;
2) отношение концентрации анионов к концентрации недиссоциированной части молекул;
3) отношение числа диссоциированных молекул к числу недиссоциированных молекул;
4) отношение числа диссоциированных молекул к общему числу молекул растворенного вещества
 21. Согласно теории Бренстеда- Лоури в реакции H3O+ H+ + H2O молекула H2O по отношению к иону H3O+ является:
21. Согласно теории Бренстеда- Лоури в реакции H3O+ H+ + H2O молекула H2O по отношению к иону H3O+ является:
1) акцептором электронной пары; 2) кислотой;
3) сопряженной кислотой; 4) сопряженным основанием
22. Протолитическая реакция CH3COOH + H2O ↔ H3O+ + CH3COO- является реакцией
1)ионизации; 2)нейтрализации; 3)гидролиз по аниону; 4)гидролиз по катиону
23. Протолитическая реакция CN- + H3O+ ↔ HCN + H2O является реакцией
1)ионизации; 2)нейтрализации;3) гидролиз по катиону4) гидролиз по аниону
24. Значение pOH раствора при pH = 7,5 равно
1). 7 2). 14 3). 6,5 4). 0,5
Теории кислот и оснований
1-3; 2-3; 3-1; 4-1; 5-3; 6-3; 7-2; 8-4; 9-3; 10-3; 11-4; 12-4; 13-4; 14-4; 15-3; 16-3; 17-2; 18-4; 19-4; 20-4; 21-2; 22-1; 23-2; 24-3.
Буферные системы
1.При добавлении НСl к буферной системе НРО42-/Н2РО4-:
1)активная концентрация НРО42-увеличивается, Н2РО4- - уменьшается;
2)активная концентрация НРО42- уменьшается, Н2РО4- - увеличивается;
3)активности компонентов не изменяются.
2.Максимаьную буферную ёмкость системы имеют при:
1)рН = pKa; 2)рН > рKa; 3)pH < pKa;
4)эти параметры не взаимосвязаны друг с другом.
3.Максимальной буферной ёмкостью при физиологическом значении рН обладает кислотно-основная сопряженная пара:
1)Н3РО4/Н2РО4-, рКа (Н3РО4) = 2,1;
2)Н2РО4-/НРО42-, рКа (Н2РО4-) = 6,8;
3)НРО42-/РО43-, рКа (НРО42-) = 12,3.
4.При одинаковых концентрациях компонентов буферная ёмкость:
1)максимальна, т. к. рН = pKa; 2)максимальна, т. к. рН > pKa;
3)минимальна, т. к. рН = pKa;
4)буферная ёмкость не зависит от соотношения концентраций компонентов.
5.Буферная ёмкость при разбавлении растворов:
1)уменьшается, вследствие уменьшения концентрации всех компонентов системы;
2)увеличивается, т. к. возрастает степень диссоциации электролитов;
3)не изменяется, т. к. соотношение концентраций компонентов остается постоянным;
4)практически не изменяется, т. к. количество компонентов системы остается неизменным.
6.Ацидоз - это:
1)уменьшение кислотной буферной ёмкости физиологической системы по сравнению с нормой;
2)увеличение кислотной буферной ёмкости физиологической системы по сравнению с нормой;
3)увеличение основной буферной ёмкости физиологической системы по сравнению с нормой.
7.Алкалоз - это:
1)уменьшение кислотной буферной ёмкости физиологической системы по сравнению с нормой;
2)увеличение кислотной буферной ёмкости физиологической системы по сравнению с нормой;
3)уменьшение основной буферной ёмкости физиологической системы по сравнению с нормой.
8.Фосфатная буферная система содержит в организме кислотно-основные сопряженные пары:
1)Н3РО4 - кислота, Н2РО4- - сопряженное основание;
2)Н2РО4- - кислота, НРО42- - сопряженное основание;
3)НРО42- - кислота, РО43- - сопряженное основание;
4)Н3РО4 - кислота, РО43-- сопряженное основание.
9.При рН > рI белковый буфер будет состоять из сопряженной кислотно-основной пары:
1)биполярной молекулы белка NH3+—Prot—COO- и катиона белка NH3+—Prot—COOH;
2)биполярной молекулы белка NH3+—Prot—COO- и аниона белка NH2—Prot—COO-;
3)аниона белка NH2—Prot—COO- и катиона белка NH3+—Prot—COOH;
4)белка NH2—Prot—СООН и аниона белка NH2—Prot—COO-.
10.При рН < pI белковый буфер будет состоять из сопряженной кислотно-основной пары:
1)биполярной молекулы белка NH3+—Prot—COO- и катиона белка NH3+—Prot—COOH;
2)биполярной молекулы белка NH3+—Prot—COO- и аниона белка NH2—Prot—COO-;
3)аниона белка NH2—Prot—COO- и катиона белка NH3+—Prot—COOH;
4)белка NH2—Prot—СООН и катиона белка NH3+—Prot—COOH.
11.При рН > рI глицин образует сопряженную кислотно-основную пару:
1)NH3+– СН2 – COO-/NH2 – СН2 – СОО-;
2)NH3+– СН2 – COO-/NH3+– СН2 – СООН;
3)NH2 – СН2 – СООН/NH2 – CH2 – COO-;
4)NH2 – CH2 – COO-/NH3+– СН2 – СООН.
12.При рН < рI глицин образует сопряженную кислотно-основную пару:
1)NH3+– СН2 – COO-/NH2 – СН2 – СОО-;
2)NH3+– СН2 – COO-/NH3+– СН2 – СООН;
3)NH2 – СН2 – СООН/NH2 – CH2 – COO-;
4)NH2 – CH2 – COO-/NH3+– СН2 – СООН.
13.Изоэлектрические точки большинства белков плазмы крови лежат в слабокислой среде, рI = 4,9-6,3, поэтому в крови в основном работает:
1)анионный белковый буфер;
2)катионный белковый буфер;
3)форма компонентов буфера не зависит от значения рН.
14.Буферная ёмкость белковой буферной системы крови больше:
1)по кислоте, т. к. в крови работает анионный белковый буфер;
2)по основанию, т. к. в крови работает катионный белковый буфер;
3)по кислоте, т. к. в крови работает катионный белковый буфер;
4)по основанию, т. к. в крови работает анионный белковый буфер.
15.Физиологическое значение рН поддерживается при соотношении компонентов бикарбонатной буферной системы, равном:
1)[НСО3-]/[СО2] = 1:20; 2)[НСО3-]/[СО2] = 4:1;
3)[НСО3-]/[СО2] = 20:1; 4)[НСО3-]/[СО2] = 1:4.
16.Физиологическое значение рН поддерживается при соотношении компонентов фосфатной буферной системы, равном:
1)[НРО42-]/[Н2РО4-] = 4:1; 2)[НРО42-]/[Н2РО4-] = 20:1;
3)[Н2РО4-]/[НРО42-] = 4:1; 4)[НРО42-]/[Н2РО4-] = 1:20.
17.При физиологическом значении рН соотношение концентраций компонентов в гидрокарбонатной буферной системе крови [НСО3-]/[СО2] = 20:1. Следовательно, буферная ёмкость этой системы по кислоте в сравнении с буферной ёмкостью по основанию:
1)больше; 2)меньше; 3)их значения равны.
18.При физиологическом значении рН соотношение концентраций компонентов в фосфатной буферной системе крови [НРО42-]/[Н2РО4-] = 4:1. Следовательно, буферная ёмкость этой системы по кислоте в сравнении с буферной ёмкостью по основанию:
1)больше; 2)меньше; 3)их значения равны.
