Элементарные реакции и кинетика полимеризации
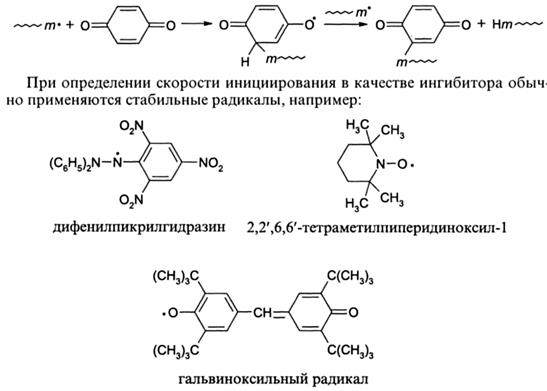
Неразветвленная цепная химическая реакция включает три последовательные стадии - инициирование, рост и обрыв кинетической цепи. Под последней понимается последовательность химических актов, возбужденных одной активной частицей или квантом. В цепной полимеризации, включая радикальную, развитие кинетической цепи сопровождается образованием цепи материальной. Поэтому для нее характерно наличие четвертой элементарной реакции - передачи кинетической цепи при ограничении цепи материальной.
Инициирование.
Реакция инициирования включает два последовательных акта: образование первичных свободных радикалов в результате распада инициатора или облучения мономера и присоединение радикалов к мономерам:
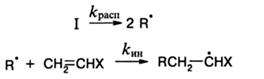
Скорость первой реакции много меньше скорости второй, поэтому именно она определяет скорость реакции инициирования:
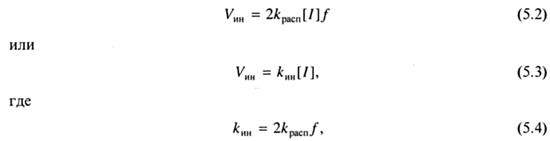
kин - константа скорости инициирования, kрасп - константа скорости распада инициатора, ƒ- эффективность инициирования.
При фотохимическом инициировании

где Iпог - интенсивность поглощенного излучения, β - число радикалов роста, т.е. растущих цепей, образованных при поглощении одного кванта.
Первичный радикал обычно атакует «хвост» мономера, т.е. метиленовую группу двойной связи, поскольку в этом случае образуется радикал роста, стабилизированный в результате сопряжения с заместителем.
Рост цепи.
Реакция роста протекает аналогично второй стадии реакции инициирования:
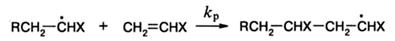
Так же как и в предыдущем случае, радикал, на этот раз радикал роста, атакует метиленовую группу двойной связи, т.е. «хвост» мономера. Такой порядок присоединения определяется как «голова» (радикал) к «хвосту» (мономер).
Обрыв цепи.
Обрыв цепи осуществляется посредством одного из двух возможных механизмов:
а) соединения (рекомбинации) радикалов
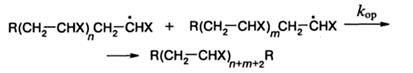
б) диспропорционирования радикалов
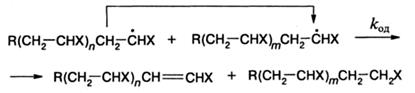
в ходе которого атом водорода предконцевого углерода одного радикала переносится к концевому атому углерода другого радикала. Чаще реализуется первая реакция, например, при полимеризации стирола и акрилатов. Вторая реакция характерна для полимеризации метилметакрилата: доля радикалов роста этого мономера, реагирующих посредством диспропорционирования, составляет 80 % при 80 °С. Механизм обрыва можно определить, зная число конечных групп-фрагментов инициатора и число макромолекул. Если отношение первого ко второму обозначить через b, то λ. - доля радикалов, принимающих участие в диспропорционировании, равна

через соединение (рекомбинация) - (1 - λ).
Уравнение, связывающее скорость радикальной полимеризации V с концентрациями мономера [M] и инициатора [I], легко может быть получено при двух допущениях:
концентрация радикалов [m•] с началом полимеризации быстро достигает постоянного значения и далее не изменяется (т. е. достигается стационарное состояние);
реакционная способность макрорадикалов не зависит от степени их полимеризации.
Первое допущение является следствием принципа стационарности Боденштейна, согласно которому при неразветвленной цепной реакции скорость образования радикалов равна скорости их гибели. Второе допущение основано на принципе Флори, согласно которому реакционная способность функциональной группы химического соединения не зависит от его молекулярной массы. Учитывая, что скорость полимеризации равна скорости роста цепи, и применяя к последней закон действия масс, получим:
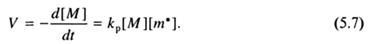
В данном случае [m•] обозначает концентрацию радикалов роста различной молекулярной массы. Вклад первичных радикалов R• в общую стационарную концентрацию радикалов ничтожен, т.к. непосредственно после образования они присоединяются к мономерам. В стационарном состоянии [m•] = const, что является следствием равенства скоростей образования и гибели радикалов (принцип стационарности):
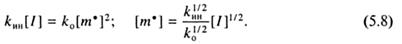
Исключая из выражения (5.7) концентрацию радикалов [m•], с помощью (5.8) получаем:

Из уравнения (5.9) следует, что скорость радикальной полимеризации пропорциональна корню квадратному из концентрации инициатора. В большинстве случаев это так, но имеются два исключения.
1. При очень больших концентрациях инициатора возможен обрыв на первичных радикалах, что ведет к уменьшению порядка по концентрации инициатора. В предельном случае, когда все растущие цепи обрываются первичными радикалами, справедливо уравнение:

где к'о - константа скорости реакции первичных радикалов с макрорадикалами. В этих условиях скорость полимеризации не зависит от концентрации инициатора.
2. При гетерогенной полимеризации, когда полимер выпадает в осадок, клубки макрорадикалов плотно свернуты, и активный конец радикала может оказаться в центре такого клубка и (или) внутри агрегата слипшихся макромолекул, недоступных для других радикалов. Это означает кинетическую гибель радикала роста, т.е. мономолекулярный обрыв. Пользуясь процедурой вывода уравнения (5.9), легко показать, что мономолекулярный обрыв ведет к первому порядку по скорости инициирования. Реально при гетерофазной полимеризации имеет место как моно-, так и бимолекулярный обрыв, поэтому порядок по концентрации инициатора 0,5 < n < 1.
Порядок по концентрации мономера достаточно редко равен единице, как это можно было бы ожидать из уравнения (5.9). Обычно он заключен между 1 и 1.5, что предположительно объясняется влиянием мономера на эффективность инициирования и скорость распада инициатора. В последнем случае допускается образование комплекса мономер-инициатор.
При фотохимическом инициировании уравнение начальной скорости полимеризации может быть получено аналогично (5.9). С учетом (5.5) имеем:

При полимеризации в присутствии фотоинициатора А с известным коэффициентом поглощения более удобно уравнение скорости, включающее интенсивность облучения:
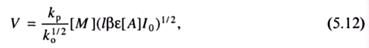
где I0 - интенсивность падающего света, е - коэффициент экстинкции или молярный коэффициент поглощения, который выражается через л/(моль·см), l -длина пути поглощаемого света, [А] - концентрация вещества, поглощающего свет.
Уравнение (5.12) применимо при фотоинициируемой полимеризации в тонких слоях. При полимеризации в более значительных реакционных объемах имеет место существенное ослабление светового потока, вследствие чего с увеличением размера реакционного сосуда скорость фотохимической полимеризации будет уменьшаться. При больших размерах с одной стороны сосуда мономер может остаться незаполимеризованным.
В отсутствие реакций передачи цепи степень полимеризации  определяется длиной кинетической цепи v, которая равна числу актов роста цепи, возбужденных одним первичным радикалом. Если обрыв цепи осуществляется путем диспропорционирования,
определяется длиной кинетической цепи v, которая равна числу актов роста цепи, возбужденных одним первичным радикалом. Если обрыв цепи осуществляется путем диспропорционирования,  = v, при соединении радикалов роста
= v, при соединении радикалов роста  = 2v. Очевидно, что длина кинетической цепи равна скорости реакции роста, деленной на скорость реакции обрыва цепи:
= 2v. Очевидно, что длина кинетической цепи равна скорости реакции роста, деленной на скорость реакции обрыва цепи:

Выражение для [m•] можно получить двояким способом - исходя из уравнения скорости роста:

или исходя из условия стационарности; используя (5.4) и (5.8) в одном случае и (5.14) - в другом, получаем из (5.13) два выражения для длины кинетической цепи:

Из уравнения (5.16) следует, что в отсутствие заметной передачи цепи степень полимеризации обратно пропорциональна корню квадратному из концентрации инициатора.
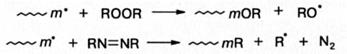
Реакции передачи цепи. Врезультате этой реакции радикал роста отрывает подвижный атом или группу атомов от неактивной молекулы и дезактивируется, а неактивная молекула становится радикалом, который дает начало новой кинетической цепи:
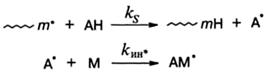
В результате передачи цепи материальная цепь ограничивается, а скорость полимеризации изменяется мало: при kин* > kp она увеличивается, при kин* < kp - уменьшается.
Передача цепи возможна на все компоненты реакционной системы - мономер, инициатор, растворитель и полимер. При полимеризации до малых степеней превращения (конверсии) мономера в полимер реакцией передачи цепи на полимер обычно пренебрегают. С учетом реакций передачи цепи средняя степень полимеризации равна отношению скорости роста к сумме скоростей всех реакций ограничения материальной цепи, включая бимолекулярный обрыв. Для дальнейших выводов удобнее использовать величину, обратную степени полимеризации:

где Син, CS, СM - относительные константы передачи цепи на инициатор, растворитель и мономер, соответственно, равные отношению констант скоростей реакций передачи и роста цепи; [S] - концентрация растворителя. Уравнение (5.18) является основным уравнением кинетики радикальной полимеризации, т.к. оно связывает скорость и степень полимеризации. Это уравнение и его модификации используют для определения значений констант передач, а также отношения kp/ k01/2.
Рассмотрим определение СM и Син. В отсутствие передатчика цепи уравнение (5.18) несколько упрощается:
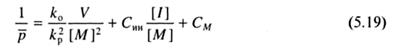
или
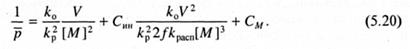
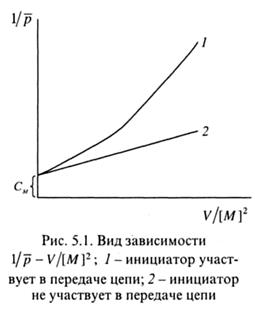
При использовании инициаторов, практически не участвующих в передаче цепи, экспериментальные данные образуют прямую линию в координатах 1/  -V/[M]2; когда инициатор участвует в передаче цепи, прямая искажается (рис. 5.1). В обоих случаях может быть определена величина константы передачи цепи на мономер СM по отрезку, отсекаемому на оси ординат.
-V/[M]2; когда инициатор участвует в передаче цепи, прямая искажается (рис. 5.1). В обоих случаях может быть определена величина константы передачи цепи на мономер СM по отрезку, отсекаемому на оси ординат.
Для нахождения значения константы передачи цепи на инициатор Cин приведем уравнение (5.20) к виду:
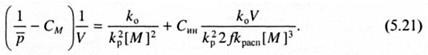
Из уравнения (5.21) следует, что построение экспериментальных данных в координатах 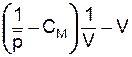 позволяет через угловой коэффициент прямой, зная константу скорости инициирования и отношение элементарных констант kо/
позволяет через угловой коэффициент прямой, зная константу скорости инициирования и отношение элементарных констант kо/ 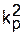 , рассчитать значение Син.
, рассчитать значение Син.
Более простой способ определения применим в том случае, когда константа передачи на мономер мала, как это и бывает в большинстве случаев. Тогда уравнение (5.19) упрощается до следующего:
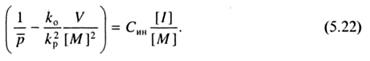
Угловой коэффициент соответствующей графической зависимости, имеет значение, равное Син.
Значения констант передачи на наиболее распространенные инициаторы приведены в табл. 5.2, из которой видно, что наиболее активны в реакции передачи цепи гидропероксиды. Большая активность гидропероксидов по сравнению с пероксидами обусловлена другим механизмом реакции:

Передача цепи на пероксиды и азонитрилы с точки зрения механизма подобна реакции индуцированного распада инициатора, рассмотренной ранее:
Таблица 5.2 Относительные константы передачи цепи на инициатор dm, 50-70°С
| Инициатор | Cин·104 | |
| Стирол | Метилметакрилат | |
| 2,2'-Азобис(изобутиронитрил) Пероксид кумила Пероксид бензоила Гидропероксид кумила | 0,12 0,01 ~0,1 0,06 | 0,02 - 0,02 0,33 |
Таблица 5.3 Относительные константы передачи цепи на мономер СМ, 60 °С
| Мономер | CМ·104 | |
| Акриламид | 0,6 | |
| Акрилонитрил | 0,26 | |
| Этилен | 0,4 | |
| Метилакрилат | 0,03-0,32 | |
| Метилметакрилат | 0,07-0,25 | |
| Стирол | 0,30-0,60 | |
| Винилацетат | 1,75-2,80 | |
| Винилхлорид | 10,8-16,0 |
Константы передачи цепи на мономер определяют максимальную степень полимеризации в массе, т.к. lim  →1/СМ. Это означает, например, что предельная молекулярная масса поливинилхлорида не может превышать 105, так как соответствующий мономер имеет наибольшую среди виниловых мономеров константу передачи СМ≈1·10-3. В целом, константы передачи цепи на виниловые мономеры (табл. 5.3) достаточно малы и не являются препятствием для получения высокомолекулярных полимеров.
→1/СМ. Это означает, например, что предельная молекулярная масса поливинилхлорида не может превышать 105, так как соответствующий мономер имеет наибольшую среди виниловых мономеров константу передачи СМ≈1·10-3. В целом, константы передачи цепи на виниловые мономеры (табл. 5.3) достаточно малы и не являются препятствием для получения высокомолекулярных полимеров.
Деградационный перенос цепи.Принципиально иное влияние оказывает реакция передачи цепи на мономер при полимеризации аллиловых мономеров. Константа передачи на них аномально велика и соответствует 4 - 10 актам нормального присоединения на один акт передачи цепи. Это объясняется большой подвижностью аллильного водорода, что, в свою очередь, связано со стабилизацией образующегося аллильного радикала:
Причиной стабилизации аллильного радикала является делокализация неспаренного электрона по π-орбитали, что может быть выражено предельными структурами:
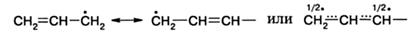
Из-за малой активности аллильный радикал не может инициировать реакцию роста и участвует лишь в реакциях бимолекулярного обрыва. Поэтому из-за передачи цепи на мономер, которая в данном случае называется деградационным переносомцепи, полимеризация аллиловых мономеров протекает с малой скоростью и приводит к образованию низкомолекулярных продуктов.
Передача цепи на растворитель.Эта реакция имеет практическое значение, поскольку часто используется в промышленности для уменьшения молекулярной массы полимера с целью улучшения его перерабатываемости. Определение константы передачи цепи Cs производится с помощью уравнения Майо:

которое может быть получено из основного уравнения полимеризации (5.18) при использовании инициатора, мало активного в реакции передачи цепи в небольших количествах, что приводит к (5.23) и соответствующей графической зависимости, представленной на рис. 5.2.
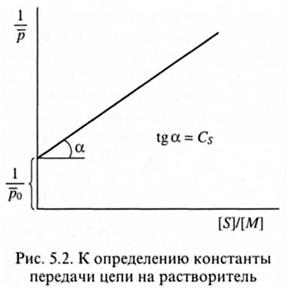
В этих условиях членом Син 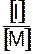 можно пренебречь. При определении Соотношение V/[M]2 во всех опытах должно оставаться постоянным, при необходимости оно может быть скорректировано путем изменения концентрации инициатора.
можно пренебречь. При определении Соотношение V/[M]2 во всех опытах должно оставаться постоянным, при необходимости оно может быть скорректировано путем изменения концентрации инициатора.
Значения констант передачи цепи на растворитель представлены в табл. 5.4.
Таблица 5.4 Значения относительных констант передачи цепи Cs·104 на некоторые соединения, 60-70°С
| Передатчик цепи | Мономер | |||
| Стирол | Акрилонитрил | Метилметакрилат | Винилацетат | |
| Бензол Циклогексан n-Бутиловый спирт Диметилсульфоксид Триэтиламин Тетрахлорид углерода Тетрабромид углерода n-Бутилмеркаптан | 0,023 0,063 0,8* 0,5 7,1 | 2,46 2,06 15,42 0,8 1,2 - | 0,83 6* 0,25 - 2,4 - | 2,4 - |
* Усредненные значения.
При полимеризации различных мономеров наиболее инертным растворителем является бензол (Cs≈10-5), затем идут углеводороды, спирты и кислоты нормального строения (Cs≈10-4). Более активны в реакции передачи цепи растворители с вторичным и, особенно, третичным атомом углерода.
Для некоторых соединений, например таких, как CCl4, CBr4, RSH, значение CS ≥ 1. Такие высокоактивные передатчики цепи, называемые регуляторами молекулярной массы полимеров,используются для ограничения молекулярной массы полимеров в процессе синтеза. В производственных условиях полимеризация ведется до глубоких конверсии, близких к 100%. Поэтому значительные отклонения CS от единицы могут привести к изменению исходного соотношения [S]/[M] в процессе полимеризации и, как следствие, к чрезмерной полидисперсности полимера.
Передача цепи на полимер.Передача цепи на полимер становится заметной лишь при полимеризации до глубоких конверсии мономеров, когда концентрация полимера достаточно высока. Она характерна для полимеризации мономеров, образующих активные радикалы роста, реакционная способность которых не снижена сопряжением с ненасыщенным заместителем. К таким мономерам относятся, прежде всего, этилен, винилацетат, винилхлорид. Особенно активна реакция передачи цепи при радикальной полимеризации этилена. Она протекает по внутри- и межмолекулярному механизму. В первом случае растущий радикал вследствие гибкости цепи атакует собственную макромолекулу. Наиболее вероятна встреча в пространстве активного конца макрорадикала с четвертым - шестым атомами углерода, например:
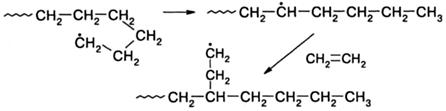
Внутримолекулярная передача цепи приводит к образованию коротких ветвей макромолекулы. При межмолекулярной передаче макрорадикал отрывает атом водорода от другой макромолекулы, что приводит к образованию длинных ветвей:
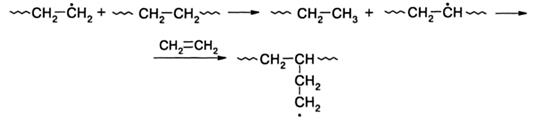
Подобный механизм разветвления характерен и для полимеризации винилацетата и винилхлорида, однако, частота ветвлений у соответствующих полимеров много меньше по сравнению с полиэтиленом. Разветвленное строение последнего оказывает большое влияние на его свойства. Это хорошо видно при сравнении свойств разветвленного полиэтилена со свойствами линейного, полученного на катализаторах Циглера-Натта. Первый имеет меньшие плотность и прочность, но большую пластичность по сравнению со вторым.
Ингибиторы радикальной полимеризации.Ингибиторы применяются в радикальной полимеризации для решения следующих задач:
предотвращения нежелательной самопроизвольной полимеризации мономера при его хранении;
регулирования скорости полимеризации с целью предотвращения взрывных режимов;
определения скорости инициирования;
осуществления полимеризации в режиме псевдоживых цепей.
Ингибитораминазываются соединения, реагирующие с радикалом - первичным или радикалом роста - с образованием соединения, неспособного к продолжению кинетической цепи, т.е. реинициированию, или малоактивного в этом направлении. Ингибитор Z может присоединяться к радикалу с образованием стабильного радикала, активность которого недостаточна для инициирования полимеризации, или насыщенного соединения (в том случае, если Z - стабильный радикал):
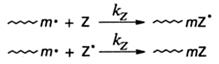
Во всех случаях активность ингибитора оценивается константойимитирования СZ=kz/kp, равной отношению констант скоростей взаимодействия радикала с ингибитором и роста цепи. Уравнение скорости радикальной полимеризации в присутствии ингибитора может быть получено тем же путем, что и (5.9), с использованием метода стационарных состояний. В данном случае в уравнение (5.8), выражающее условие стационарности, необходимо ввести слагаемое, отражающее обрыв растущих цепей на ингибиторе:
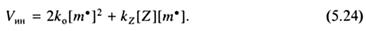
Выразив концентрацию радикалов через (5.7), приходим к соотношению:
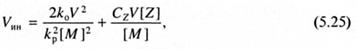
которое содержит в неявной форме скорость радикальной полимеризации V. При преимущественном обрыве кинетических цепей в результате реакции радикалов роста с ингибитором уравнение (5.25) принимает более простую форму:

Из уравнения (5.26) следует, что скорость ингибированной полимеризации пропорциональна скорости инициирования. Напомним, что в отсутствие ингибитора скорость радикальной полимеризации пропорциональна корню квадратному из скорости инициирования.
Все ингибиторы делятся на сильные и слабые. Последние обычно применяются для снижения скорости полимеризации с целью предотвращения чрезмерного разогрева реакционной системы и связанных с этим нежелательных последствий. Слабые ингибиторы реагируют с радикалами роста, достигшими достаточно большой степени полимеризации порядка 102—103. Продукты их взаимодействия с радикалами роста могут инициировать рост новых цепей:
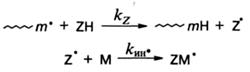
В отличие от передатчиков цепи в данном случае kин*<<kp, что приводит к существенному уменьшению скорости полимеризации. Поэтому слабые ингибиторы называются также замедлителями полимеризации.Пример, отражающий их влияние на скорость полимеризации, приведен на рис. 5.3 (кривая 3).
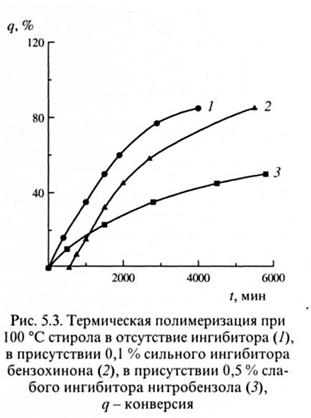
Сильные ингибиторы реагируют с радикалами роста, содержащими 1-2 мономерных звена, или с первичными радикалами, когда вероятность бимолекулярного обрыва ничтожна. На этом основан очень производительный метод измерения скорости инициирования Vин. Если в систему, помимо инициатора, ввести ингибитор, то полимеризация не пойдет в течение некоторого времени 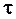 и, называемого индукционным периодом, пока не прореагируют все молекулы ингибитора. Если каждая из них взаимодействует с одним радикалом роста, то скорость расхода ингибитора [Z]/
и, называемого индукционным периодом, пока не прореагируют все молекулы ингибитора. Если каждая из них взаимодействует с одним радикалом роста, то скорость расхода ингибитора [Z]/ 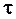 и равна скорости генерирования радикалов, т. е. скорости инициирования. Обычно ставят несколько опытов с разными концентрациями ингибитора, тогда:
и равна скорости генерирования радикалов, т. е. скорости инициирования. Обычно ставят несколько опытов с разными концентрациями ингибитора, тогда:
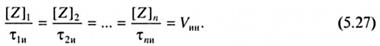
Данный метод корректен лишь в тех случаях, когда ингибитор не вызывает никаких побочных реакций, в частности реинициирования. Критерием отсутствия побочных реакций является равенство скоростей полимеризации в отсутствие ингибитора и в его присутствии по окончании индукционного периода (см. рис. 5.3, кривые 1, 2). В табл. 5.5 представлены константы ингибирования ряда соединений. Обращает на себя внимание большое влияние природы мономера, точнее, соответствующего ему радикала, на величину константы ингибирования. Особенно велико значение полярного фактора. Так, константа ингибирования нитробензолом радикальной полимеризации метилакрилата на два порядка меньше по сравнению с полимеризацией стирола. Радикал роста метилакрилата и нитробензол имеют электроноакцепторные заместители, а радикал роста стирола - электронодонорный. Это означает, что преимущественно взаимодействуют радикалы и ингибиторы, имеющие противоположную поляризацию активных центров. Аналогичны примеры с бензохиноном и CuCl2. Большое влияние на константу ингибирования оказывает также активность радикалов. Так, нитробензол в 30 раз более активен в реакции с радикалом роста винилацетата по сравнению с радикалом роста стирола, реакционная способность которого снижена из-за сопряжения ненасыщенного углерода с ароматическим заместителем.
Для стабилизации мономеров часто используется гидрохинон, который активен лишь при наличии примесей кислорода: роль последнего заключается в окислении гидрохинона до хинона. Радикалы реагируют с хиноном по двум направлениям - путем атаки атомов кислорода:
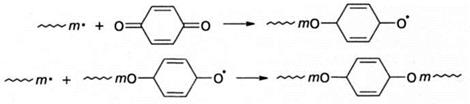
Таблица 5.5 Константы ингибирования Cz, 50-60 °С
| Ингибитор | Мономер | 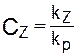 |
| Нитробензол | Метилметакрилат Стирол Винилацетат | 0,00464 0,326 11,2 |
| Бензохинон | Метилметакрилат Стирол | 5,7 |
| CuCl2 | Метилметакрилат Стирол | ~1000 ~11000 |
| Дифенилпикрилгидразин | Метилметакрилат | |
| Кислород | Метилметакрилат Стирол |
или ароматического кольца:
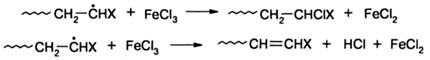
Для ингибирования полимеризации могут быть использованы соли металлов переменной валентности, например FeCl3, CuCl2. Последняя часто используется при очистке мономеров ректификацией для обработки элементов насадки - колец Рашига, спиралек и т.д. Реакция ингибирования с участием CuCl2 или FeCl3 является окислительно-восстановительной:
Определение абсолютных значений констант скоростей элементарных реакций.Рассмотренные представления и кинетические схемы позволяют определить лишь отношение констант элементарных реакций роста и обрыва цепи, что может быть сделано двумя способами. При радикальной полимеризации в массе с небольшим количеством инициатора, малоактивного в реакции передачи цепи, уравнение (5.19) с учетом механизма обрыва цепи сводится к уравнению:
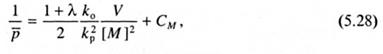
где λ - доля радикалов, участвующих в диспропорционировании. Экспериментальные данные, представленные графически в координатах 1/  - V/[М]2, позволяют определить СM и отношение ko/
- V/[М]2, позволяют определить СM и отношение ko/ 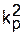 (рис. 5.4).
(рис. 5.4).
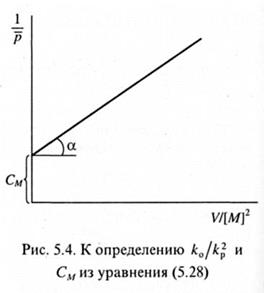
В последнем случае необходимо знать значение λ. Оно может быть рассчитано исходя из данных по числу концевых групп, приходящихся на одну макромолекулу, согласно (5.6). В конечном итоге имеем:
В последнее время используют более производительный метод, рассмотренный выше, в основе которого лежит определение скорости инициирования методом радикальных ингибиторов. Зная скорость инициирования, легко можно рассчитать отношение ko/ 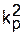 через начальную скорость полимеризации:
через начальную скорость полимеризации:

Для определения раздельных значений констант скоростей роста и обрыва необходимо новое уравнение, не зависимое от рассмотренных ранее. В качестве него обычно используется выражение, включающее среднее время жизни радикала 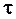 , т. е. время от зарождения кинетической цепи до ее гибели в результате бимолекулярного обрыва. В стационарном режиме полимеризации:
, т. е. время от зарождения кинетической цепи до ее гибели в результате бимолекулярного обрыва. В стационарном режиме полимеризации:
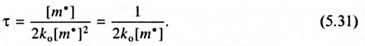
Выражая как обычно концентрацию радикалов, исходя из уравнения скорости роста, окончательно имеем:

Таким образом, проблема определения раздельных значений констант скоростей роста и обрыва цепи сводится к определению 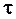 . В течение длительного времени основным экспериментальным методом определения
. В течение длительного времени основным экспериментальным методом определения 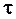 являлся метод «вращающегося сектора», в котором инициирование осуществлялось фотохимически, а световой поток периодически прерывался при вращении диска с вырезами. Детали метода и соответствующая ему теория псевдостационарной полимеризации изложены во многих учебниках и монографиях. Найденные значения
являлся метод «вращающегося сектора», в котором инициирование осуществлялось фотохимически, а световой поток периодически прерывался при вращении диска с вырезами. Детали метода и соответствующая ему теория псевдостационарной полимеризации изложены во многих учебниках и монографиях. Найденные значения 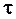 для различных мономеров и условий полимеризации находятся в интервале от 0,1 до 10 с. Это означает, что отрезок времени между двумя актами роста равен примерно 10-4с (с точностью до порядка).
для различных мономеров и условий полимеризации находятся в интервале от 0,1 до 10 с. Это означает, что отрезок времени между двумя актами роста равен примерно 10-4с (с точностью до порядка).
В последние годы наиболее достоверным методом определения абсолютных констант скоростей роста и обрыва цепи был признан метод пульсирующей лазерной полимеризации (ПЛП). При облучении реакционного сосуда с мономером пульсирующим лазерным излучением достаточно большой мощности каждый импульс порождает огромное количество радикалов, которые «убивают» практически все предшествующие радикалы. Некоторая часть «уцелевших» новых радикалов инициирует полимеризацию, однако, макрорадикалы растут только до следующего импульса, после которого все повторяется сначала. Очевидно, что средняя длина цепи в таких условиях будет равна:

где ∆t - время между импульсами. Для нахождения kp при известных [М] и ∆t достаточно определить среднечисловую молекулярную массу полимера, что обычно делается с помощью гель-хроматографии. Анализ кривой молекулярно-массового распределения, представленной на хроматограмме, позволяет определить также и ko. Однако проще и надежнее сделать это из отношения kр/ko1/2, зная значение kp, определенное из (5.33). В табл. 5.6 приведены значения констант скоростей роста и обрыва цепи для наиболее распространенных мономеров, а также значения kp/ko1/2. Значения константы скорости реакции обрыва на 4 - 5 порядков превышают значения константы скорости реакции роста - бимолекулярные реакции радикалов являются одними из наиболее быстрых реакций, известных в химии.
Таблица 5.6 Константы скоростей элементарных реакций роста и обрыва при радикальной полимеризации некоторых мономеров, 20 — 25 °С
| Мономер | kp, л·моль-1·c-1 | kо·10-8 л·моль-1·c-1 | kр/ko1/2 л1/2·моль-1·c-1/2 |
| Винилхлорид | 0,0218 | ||
| Акриламид вода диметилсульфоксид | 7,2 2,5 | 0,350 0,0171 | |
| Акрилонитрил | 2,9 | 0,112 | |
| Винилацетат | 0,5 | 0,141 | |
| Метилакрилат | 0,065 | 0,228 | |
| Метилметакрилат | 0,4 | 0,0810 | |
| Стирол | 0,5 | 5,66·10-2 | |
| Бутадиен-1,3 (60 °С) | - | ||
| Метакриловая кислота вода диметилсульфоксид | 0,4 0,015 | 0,12 0,09 | 1,15·10-4 5,00·10-6 |
При равной скорости инициирования отношение kр/ko1/2 определяет скорости полимеризации различных мономеров. Из табл. 5.6 видно, что значения отношения kр/ko1/2 изменяются в широких пределах, причем наиболее активными в полимеризации оказываются мономеры, в которых отсутствует прямое сопряжение двойной связи с каким-либо ненасыщенным заместителем. Это хорошо видно из сравнения значений kр/ko1/2 для стирола и винилацетата. Причины этого будут рассмотрены в разделе, посвященном реакционной способности мономеров и радикалов.
