На чем основан общий принцип получения свободных галогенов в технике и лаборатории? Какова особенность получения фтора и где его применяют? Что
Подгруппа фтора – ГАЛОГЕНЫ.
Дайте общую характеристику p-элементов VII группы, исходя из их положения в периодической системе и сравнивая: электронные конфигурации атомов, радиусы, энергию ионизации и энергию сродства к электрону, электроотрицательность. Какие степени окисления характерны для атомов галогенов? Какие из них являются наиболее устойчивыми? Почему? В виде каких соединений эти элементы встречаются в природе?
К элементам VII (в новой номенклатуре ЮПАК она обозначена как 17 группа) относятся фтор (F), хлор (Cl), бром (Br), иод (I), астат (At). Название этих элементов - галогены (греч. "рождающие соли") - обусловлено тем, что большинство их соединений с металлами представляют собой типичные соли (KCl, NaCl и т.д.).
Многие соединения галогенов, например, поваренная соль (от лат. sal) известны людям с незапамятных времен. Соляную кислоту (лат. spiritus salis) впервые выделили алхимики сухой перегонкой купоросов, квасцов и поваренной соли. Свободный хлор (от греч. сhloros - желто-зеленый) был получен Карлом Шееле (1742-1786) действием соляной кислоты на пиролюзит (MnO2). Долгое время его называли окисленной муриевой кислотой, считая оксидом элемента мурия (от греч. muria - рассол). Взаимодействие хлора с раствором KOH изучал Клод Бертолле (1748-1822) - выделенный им хлорат калия до сих пор носит его имя.
Проблема выделения свободного фтора (от греч. phthoros - гибель) волновала многие поколения химиков. Однако решить ее удалось лишь в 1886г. Муассану, получившему незначительные количества F2 электролизом HF.
Бром (от греч. bromos - зловонный) был открыт в 1825 г. Балларом из соляного рассола действием пиролюзита в кислой среде.
В 1811 г. из золы морских водорослей Бернаром Куртуа был получен иод (от греч. iodes - фиолетовый).
Астат 85Аt (иногда его называют астатином) получен бомбардировкой ядер висмута  -частицами.
-частицами.
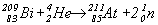
Таблица 1.Некоторые характеристики атомов галогенов.
| Атом | Электронная конфигурация | Орбитальный атомный радиус ( 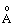 ) ) | Еср Сродство к электрону эВ (кДж/моль) | Eион Первая энергия ионизации эВ(кДж/моль) | О Электроотрица- тельность* ) | Устойчивые Степени окисления |
| 9F | [He]2s22p5 | 0.39 | 3.45(333) | 17.42(1682) | 4.1 | -1; 0 |
| 17Cl | [Ne]3s23p53d0 | 0.73 | 3.7 (348) | 12.97(1255) | 2.9 | -1;0;+1;+3; (+4); +5; (+6); +7. |
| 35Br | [Ar]3d104s24p54d0 | 0.85 | 3.4(325) | 11.81(1143) | 2.8 | -1; 0; +1; +3; (+4); +5; +7. |
| 53I | [Kr]4d105s25p55d0 | 1.04 | 3.1(295) | 10.47(1012) | 2.2 | -1; 0; +1;+3; +5; +7. |
В основном состоянии атомы галогенов имеют электронную конфигурацию ns2np5, где n - главное квантовое число, или номер периода. По сравнению с атомами других галогенов у атомов фтора 2s2 и 2p5 электроны слабо экранированы от ядра, что приводит к высокой удельной (на единицу объема) электронной плотности и, соответственно, меньшему радиусу, большим значениям энергии ионизации и электроотрицательности. При переходе от фтора к иоду размер атомов и возможные координационные числа увеличиваются, а энергии ионизации и электроотрицательность (ЭО) уменьшаются.
Свойства фтора, как и других элементов второго периода (Li-F), отличаются от свойств более тяжелых элементов соответствующих групп. Например, сродство к электрону у фтора меньше, чем у хлора. Это связано с высокой электронной плотностью и сильным межэлектронным отталкиванием. При переходе от хлора к иоду сродство к электрону уменьшается из-за увеличения радиуса атома галогена. К особенностям фтора относится также высокая электроотрицательность, что приводит к тому, что для фтора из всех возможных степеней окисления -1, 0, +1, +3, +5, +7 характерны только две первых. Следует также отметить высокие по сравнению с другими галогенами энтальпии образования ионных и ковалентных фторидов. В случае ионных фторидов это обусловлено небольшим размером иона 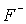 , сильным кулоновским взаимодействием и, соответственно, высокой энергией кристаллической решетки. Высокая энтальпия образования ковалентных фторидов связана с малым радиусом атома фтора, с большим по сравнению с другими галогенами перекрыванием атомных орбиталей и с более прочной ковалентной связью. Например, в молекулах NF3 и NCl3 энергии связи N-X составляют 272 и 193 кДж/моль, соответственно.
, сильным кулоновским взаимодействием и, соответственно, высокой энергией кристаллической решетки. Высокая энтальпия образования ковалентных фторидов связана с малым радиусом атома фтора, с большим по сравнению с другими галогенами перекрыванием атомных орбиталей и с более прочной ковалентной связью. Например, в молекулах NF3 и NCl3 энергии связи N-X составляют 272 и 193 кДж/моль, соответственно.
Галогены проявляют положительные степени окисления в соединениях с более электроотрицательными элементами, например, с фтором (ClF7, IF7) и кислородом. Соединения, в которых атом галогена выступал бы как одновалентный катион Х+, неизвестны, поскольку энергетические затраты на ионизацию не компенсируются энергией кристаллической решетки и сольватации. Однако для иода и брома известны комплексные соединения, например, 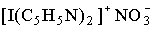 , в которых атом галогена находится в положительной степени окисления +1, +3.
, в которых атом галогена находится в положительной степени окисления +1, +3.
Астат по своим свойствам напоминает иод, например, идентифицированы соединения HAt, CH3At, BiAt, Ba(AtO3)2. Однако соединения с высшей степенью окисления At (VII) не получены.
2. Дайте сравнительную характеристику образуемых галогенами простых веществ, указав тип химической связи, характер изменения стандартных энтальпий образования (DH0обр.) и диссоциации молекул Hal2. агрегатного состояния простых веществ при обычных условиях. Как изменяются межъядерное расстояние и энергия связи в ряду F2-Cl2-Br2-I2? Чем это объясняется?
В парообразном, жидком и твердом состояниях галогены построены из двухатомных молекул Х2. Для оценки энергий молекулярных орбиталей полезна информация об энергиях исходных атомных орбиталей.
На рис.1 представлено изменение энергии ns- и np-атомных орбиталей для атомов элементов первого, второго, третьего и четвертого периодов периодической системы Д.И.Менделеева. 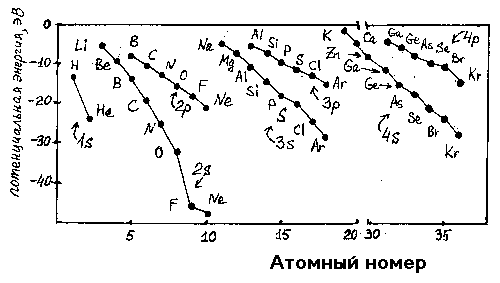
Рис.1. Энергия Е (эВ) ns- и np-атомных орбиталей атомов элементов 1-го, 2-го, 3-го 4-го периодов.
Энергии отрицательны, так как при взаимодействии положительно заряженного ядра и отрицательно заряженных электронов энергия выделяется. При переходе от Li к Ne растут заряд ядра, прочность связи с ядром 2s-электронов и их экранирующее действие на электроны 2p-орбиталей. Таким образом, в этом ряду разница энергии 2s- и 2p-орбиталей увеличивается. Эффект экранирования приводит к увеличению энергии 3s- и 3p-, 4s- и 4p-орбиталей и т.д., а главное, к уменьшению их разности по сравнению с 2s- и 2p-орбиталями: если для фтора разница в энергии орбиталей составляет 27.7 эВ, то для хлора - 11.6 эВ.
Существенное различие энергий 2s- и 2p-орбиталей у фтора, как и у кислорода, приводит к незначительному вкладу 2s-орбиталей в образование 3  св. и 4
св. и 4  разр молекулярных орбиталей. В результате на энергетической диаграмме молекулы F2 орбиталь 3
разр молекулярных орбиталей. В результате на энергетической диаграмме молекулы F2 орбиталь 3  св располагается ниже 1-
св располагается ниже 1-  св -орбиталей (рис.2а).
св -орбиталей (рис.2а).
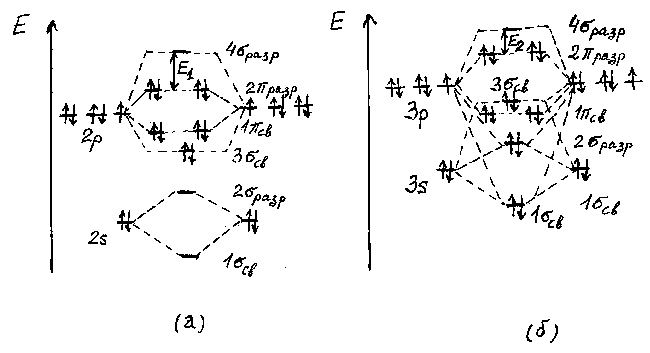
Рис.2. Схема энергетических диаграмм молекулярных орбиталей F2 (a) и Cl2 (б).
При переходе от фтора к иоду энергия ns- и np-атомных орбиталей увеличивается, а их разность уменьшается. Следует отметить, что при этом уменьшается и разность энергий между наивысшей занятой и наинизшей свободной молекулярными орбиталями: Е1 > Е2 (рис.2). Соотношение между величинами Е1 и Е2 имеет важное значение для объяснения окраски галогенов. Уменьшение разницы энергии ns- и np-орбиталей приводит и к увеличению энергии молекулярных орбиталей. Но отсюда нельзя сделать однозначного вывода относительно изменения в ряду F2-I2 энергии связи Х-Х, так как последняя связана с разницей в энергии молекулярных и атомных орбиталей сложным образом . Однако следует отметить, что наличие электронов на разрыхляющих молекулярных орбиталях приводит к дестабилизации молекулы, особенно при малом ее размере. Например, энергия связи F-F заметно меньше, чем Cl-Cl и Br-Br, и лишь ненамного больше, чем I-I. Это обусловлено малым размером атома фтора и сильным отталкиванием четырех электронов на разрыхляющих орбиталях (рис.2). Такая же особенность в изменении энергий связи характерна и для молекул VI(16), V(15) и IV(14) групп периодической системы элементов.
Таблица 2.Сравнение свойств молекул и простых веществ.
| Галоген | Цвет | Тпл,оС | Ткип,оС | 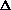 Ногом.х), кДж/моль Ногом.х), кДж/моль | 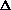 Ногетер.хх), кДж/моль Ногетер.хх), кДж/моль |
| F2 | бесцветный | -219.6 | -188.1 | ||
| Cl2 | желто-зеленый | -101.0 | -34.1 | ||
| Br2 | красно-бурый | -7.2 | 59.2 | ||
| I2 | фиолет.(пар) черный (кр.) | 113.6 | 185.5 |
Температуры плавления (Тпл.) и кипения (Ткип.) (табл.2) монотонно увеличиваются от фтора к иоду. Этот факт связан с ростом размеров молекул и усилением межмолекулярного взаимодействия (сил Ван-дер-Ваальса).
Хлор, бром и иод слабо растворимы в воде (фтор энергично взаимодействует с водой) . Так, при 200С в 100 г воды может быть растворено 0.7 г Cl2; 3.58 г Br2 и 0.028 г I2. Значительно лучше галогены растворимы в неполярных и малополярных органических растворителях.
3. Охарактеризуйте химические свойства свободных галогенов: отношение к металлам и неметаллам, воде, щелочам (при ~200С и при нагревании). Сравните их окислительную активность. Особенности химии фтора. Фторид ктслорода. В чем выражается отличие в поведении фтора по отношению к воде и щелочам от поведения остальных галогенов? Что представляют собой интергалогениды (межгалоидные соединения)?
| Неметаллы | Фтор | Хлор | Бром | Иод |
| He, Ne, Ar | Не взаимодействуют. | |||
| Kr, Xe | ЭFn , n = 2,4,6. | Не взаимодействуют. | ||
| Галогены | XF (X=Cl, Br, I); BrCl, ICl, IBr XF3 (X=Cl, Br, I); I2Cl6 XF5 (X=Cl, Br, I) XF7 (X=I) | |||
| О2 | F2O2 (в электр.разряде) | Не взаимодействуют. | ||
| S | SF6, S2F10 | S2Cl2, SCl2,SCl4 | S2Br2 | Не реагирует. |
| N2 | Не взаимодействуют. | |||
| P | PХ3 и РХ5 | PI3, P2I4,PI5(?) | ||
| H2 | Со взрывом в темноте | Со взрывом на свету. | Реагирует выше 2000С; Pt-катализатор | Равновесие H2+Г2=2НГ смещено влево |
| Металлы | Загораются | Реагируют при нагревании. |
Взаимодействие галогенов с водой - сложный процесс, включающий растворение, образование сольватов и диспропорционирование.
Фтор в отличие от других галогенов воду окисляет:
2H2O + 2F2 = 4HF + O2.
Однако при насыщении льда фтором при -400С образуется соединение HFO. Растворимость (моль/л) хлора, брома и иода в воде незначительна, причем с повышением температуры для хлора она уменьшается, брома - практически не меняется, а иода - увеличивается.
Равновесие можно сместить вправо добавлением щелочных реагентов, например, Na2CO3:
Cl2 + Na2CO3 + H2O = NaHCO3 + NaCl + HClO , а также добавлением суспензий оксидов ртути (II) или висмута Bi2O3 для перевода в осадок хлорид-ионов:
Cl2 + 2HgO + H2O = HgO . HgСl2 + 2HClO, 2 Cl2 + Bi2O3 + H2O = 2BiOCl + 2HClO.
Приведенные реакции используют для получения HClO, HBrO, HIO.
Диспропорционирование гипогалогенит-ионов термодинамически наиболее вероятно до галогенид- и галогенат-ионов. Скорости реакций и, значит, состав продуктов взаимодействия галогенов с водой существенно зависят от температуры. Несмотря на близость величин констант равновесия реакций и для хлора, скорость первой из них существенно больше, чем второй. Высокая энергия активации реакции обусловлена повышением прочности связи и увеличением экранирования хлора в ряду 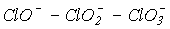
Скорость реакции сильно зависит от температуры. Так, при действии хлора на эффективно охлаждаемый раствор щелочи образуются гипохлориты, например, жавелевая вода:
2NaOH + Cl2 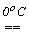 NaClO + NaCl +H2O. При взаимодействии же хлора с неохлаждаемым раствором щелочи происходит разогревание раствора и получаются хлораты, например, бертолетова соль KClO3:
NaClO + NaCl +H2O. При взаимодействии же хлора с неохлаждаемым раствором щелочи происходит разогревание раствора и получаются хлораты, например, бертолетова соль KClO3:
6KOH + 3Cl2 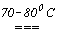 KClO3 +5KCl + 3H2O. Таким образом, совокупность термодинамических и кинетических факторов обуславливает следующий состав продуктов взаимодействия в системе Cl2+H2O: растворенный в воде хлор (он преобладает), HCl, HClO, HClO3. При насыщении хлором холодной воды (0-20оС) часть молекул Cl2 диспропорционирует: Cl2 + H2O = HCl + HClO, при этом кислотность раствора постепенно увеличивается. При насыщении хлором горячей воды (>20оС) растворимость хлора существенно уменьшается, а вместо HClO в растворе накапливается хлорноватая кислота HClO3. Бром и иод взаимодействуют с водой аналогично хлору. Однако увеличение размеров атома галогена и аниона
KClO3 +5KCl + 3H2O. Таким образом, совокупность термодинамических и кинетических факторов обуславливает следующий состав продуктов взаимодействия в системе Cl2+H2O: растворенный в воде хлор (он преобладает), HCl, HClO, HClO3. При насыщении хлором холодной воды (0-20оС) часть молекул Cl2 диспропорционирует: Cl2 + H2O = HCl + HClO, при этом кислотность раствора постепенно увеличивается. При насыщении хлором горячей воды (>20оС) растворимость хлора существенно уменьшается, а вместо HClO в растворе накапливается хлорноватая кислота HClO3. Бром и иод взаимодействуют с водой аналогично хлору. Однако увеличение размеров атома галогена и аниона 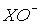 приводит к повышению скорости диспропорционирования. Поэтому, несмотря на большое значение константы равновесия реакции, скорость этой реакции при переходе от хлора к брому и иоду существенно увеличивается. В результате ион
приводит к повышению скорости диспропорционирования. Поэтому, несмотря на большое значение константы равновесия реакции, скорость этой реакции при переходе от хлора к брому и иоду существенно увеличивается. В результате ион 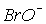 в растворах можно обнаружить лишь при температурах ниже 00С. Скорость диспропорционирования иона
в растворах можно обнаружить лишь при температурах ниже 00С. Скорость диспропорционирования иона 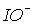 велика при любой температуре, поэтому в растворах он не существует. Кроме того, появление HХ повышает кислотность и смещает равновесие влево. Таким образом, бром и иод при растворении в воде остаются в форме Br2 и I2.
велика при любой температуре, поэтому в растворах он не существует. Кроме того, появление HХ повышает кислотность и смещает равновесие влево. Таким образом, бром и иод при растворении в воде остаются в форме Br2 и I2.
По химическим свойствам галогены - самые активные неметаллы. Из-за низкой энергии диссоциации и высокой энергии гидратации иона 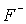 наиболее реакционно-способным из галогенов оказывается фтор. Он взаимодействует непосредственно со всеми элементами Периодической таблицы Д.И.Менделеева, кроме He, Ne, Ar. В атмосфере фтора сгорают вода 2H2O + 2F2 = 4HF + O2 и стеклянная вата SiO2 + 2F2 = SiF4 + O2 . Если же элемент может проявлять несколько степеней окисления, то, как правило, образуются высшие возможные фториды (SF6 , VF5, XeF6 и т.д.). Взаимодействие фтора с некоторыми переходными металлами, например, никелем, протекает крайне медленно из-за образования на их поверхности тонкой защитной пленки соответствующего фторида металла. От фтора к иоду окислительная способность уменьшается, а восстановительная - увеличивается.
наиболее реакционно-способным из галогенов оказывается фтор. Он взаимодействует непосредственно со всеми элементами Периодической таблицы Д.И.Менделеева, кроме He, Ne, Ar. В атмосфере фтора сгорают вода 2H2O + 2F2 = 4HF + O2 и стеклянная вата SiO2 + 2F2 = SiF4 + O2 . Если же элемент может проявлять несколько степеней окисления, то, как правило, образуются высшие возможные фториды (SF6 , VF5, XeF6 и т.д.). Взаимодействие фтора с некоторыми переходными металлами, например, никелем, протекает крайне медленно из-за образования на их поверхности тонкой защитной пленки соответствующего фторида металла. От фтора к иоду окислительная способность уменьшается, а восстановительная - увеличивается.
4. В какой последовательности галогены вытесняют друг друга из водных растворов галидов? Объясните характер и причины изменения окислительно-восстановительных свойств свободных галогенов. Почему нельзя получить F2 окислением фторид-иона хлором? Ответ подтвердите величинами окислительно-восстановительных потенциалов.
Химическая активность галогенов от фтора к йоду уменьшается. Поэтому более активный галоген (имеющий наиболее высокое значение элетроотрицательности) вытесняет менее активный галоген из его соединений с металлами. Так, фтор вытесняет все другие галогены из их галогенидов, хлор -бром и иод, а бром – только иод:
2 NаBr + С12 = 2 NаС1 + Br2
2 NаI + С12 = 2 NаС1 + I2
2 К I + Br2 = 2 КBr + I2
2 КBr + I2 ≠
Окислительные свойства галогенов ослабевают в ряду F2> Cl2> Br2> I2
| F2 + 2e = 2F– | Eo = + 2,87В |
| Cl2 + 2e=2Cl– | Eo= +1,36В |
| Br2+ 2e= 2Br– | Eo= + 1,06В |
| I2 +2e = 2I– | Eo= + 0,54В |
На чем основан общий принцип получения свободных галогенов в технике и лаборатории? Какова особенность получения фтора и где его применяют? Что
