СПОСОБЫ ВЫРАЖЕНИЯ СОСТАВА РАСТВОРОВ. При изучении данной темы нужно усвоить наиболее часто употребляемые в химии способы
При изучении данной темы нужно усвоить наиболее часто употребляемые в химии способы выражения содержания растворенного вещества в растворе: массовая доля, титр раствора, моляльная концентрация, молярная концентрация, молярная концентрация эквивалентов; научиться практически рассчитывать концентрацию раствора всеми этими способами.
Концентрация раствора – это относительное содержание растворенного вещества в единице объема, в единице массы раствора или растворителя [1 – 5, 8].
7.1. Растворы и способы выражения их концентрации
Растворами называются гомогенные (однородные) системы переменного состава, состоящие из двух или более компонентов. В зависимости от агрегатного состояния различают газовые, жидкие и твердые растворы. Газовые растворы, чаще называемые газовыми смесями, как правило, характеризуются любым соотношением компонентов (неограниченная растворимость) и подчиняются законам идеальных газов, если давление и температура не очень велики. При повышении давления законы идеальных газов становятся ошибочными, а при очень высоких давлениях (тысячи атмосфер) может наблюдаться даже ограниченная растворимость газов. Жидкие и твердые растворы могут характеризоваться неограниченной и ограниченной растворимостью компонентов. В случае ограниченной растворимости растворы могут быть ненасыщенными, насыщенными и пересыщенными. Пересыщенные растворы термодинамически неустойчивы.
Термодинамические свойства растворов и составляющих его компонентов зависят от температуры, давления и концентрации. Концентрация раствора определяется относительным содержанием компонентов. В зависимости от того, к какой величине относится количество компонента (оно в свою очередь может быть определено по-разному), существуют различные способы определения концентрации раствора (табл. 2.1).
Таблица 2.1
Способы выражения состава растворов
| Название | Обозначение | Математическое выражение | Размерность |
| Массовая доля | wi | 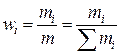 | — |
| Молярная доля | хi | 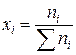 | — |
| Молярная концентрация | ci | 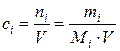 | моль/л; кмоль/м3 |
| Молярная концентрация эквивалентов | cэк, i | 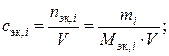 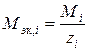 | моль/л; кмоль/м3 |
| Моляльность | cm, i | 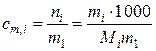 | моль/кг |
Примечания: i – символ компонента раствора; i = 1 – символ растворителя;
m, тi – масса раствора и компонента раствора, г; zi – эквивалентное число компонентов раствора; V – объем раствора; Mi, Mэк, i – молярная и эквивалентная массы компонентов раствора.
1.1. Молярная доля, молярный процент
Свойства растворов определяются взаимодействием составляющих его частиц, поэтому самым естественным способом определения концентрации является молярная доля компонента – отношение числа молей компонента к общему числу молей веществ, составляющих раствор. Молярная доля любого компонента
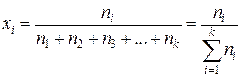 , i = 1, 2, 3, …, k. (II.1)
, i = 1, 2, 3, …, k. (II.1)
Здесь i – индекс (номер) компонента раствора; k – число компонентов раствора. Возможные значения молярной доли компонента при неограниченной растворимости от хi = 0 (i-го компонента в растворе нет) до хi = 1 (чистое i-е вещество). Молярная доля, умноженная на 100, называется молярным процентом
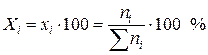 . (II.2)
. (II.2)
Сумма молярных долей (мол.%) всех компонентов раствора равняется 1 (100%)
Sхi = 1, SXi = 100. (II.3)
Хотя для растворов с неограниченной растворимостью понятие «растворитель» и «растворенное вещество» условные, тем не менее компонент с молярной долей 0,5 < х1 < 1 называется растворителем и ему присваивается индекс i = 1.
Для смеси идеальных газов справедливы соотношения
PV = (Sni)RT, piV = niRT, pi = xiP, Spi = P,
где Р – давление газовой смеси, V – объем смеси, Т – температура, pi – парциальное давление компонента газовой смеси.
1.2. Массовая доля, массовый процент
Отношение массы i-го компонента к массе раствора называется массовой долей, а умноженная на 100 массовая доля определяет массовый процент (мас.%; % по массе) компонента:
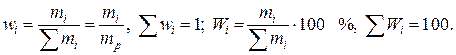 (II.4)
(II.4)
Часто на практике массовые проценты компонентов обозначаются [i], % или (i), %. Например, концентрации легирующих компонентов стали обозначаются
WC = [C], %; WMn = [Mn], %; WO = [O], % и т.д.,
а состав шлака обозначается
WFeO = (FeO), %; 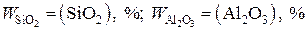 и т.д.
и т.д.
1.3. Молярная концентрация вещества,
молярная концентрация эквивалентов вещества
В химии низкотемпературных жидких (в том числе водных) растворов, в аналитической химии концентрация растворенного вещества чаще всего определяется отношением числа молей его к объему раствора. Если объем раствора измерить в литрах (л), то такая концентрация называется молярной концентрацией i-го вещества (для краткости в дальнейшем ее будем называть молярностью)
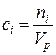 (моль/л),
(моль/л), 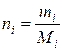 , (II.5)
, (II.5)
где Мi – молярная масса компонента, г/моль; Vp – объем раствора, л.
Химическое взаимодействие веществ подчиняется закону эквивалентов, поэтому при стехиометрических расчетах реакций в водных растворах удобно пользоваться молярной концентрацией эквивалента вещества(для краткости – нормальностью) – числом молей эквивалентов растворенного вещества в литре раствора
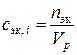 (моль эквивалентов/л),
(моль эквивалентов/л), 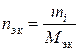 . (II.6)
. (II.6)
Молярная масса эквивалента растворенного вещества (кислоты, щелочи, соли), формула которого 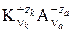 , определяется соотношением
, определяется соотношением
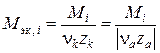 . (II.7)
. (II.7)
Здесь nk, na – число катионов и анионов в молекуле растворенного вещества;
zk, za – заряды катиона и аниона.
Величина z* = nk zk = |na za| называется числом эквивалентности. Следовательно, эквивалент – некая реальная или условная частица в z* раз меньшая атома, молекулы. Например, молярная масса эквивалентов
серной кислоты 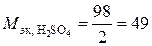 г/экв;
г/экв;
гидроксида хрома 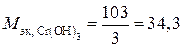 г/экв;
г/экв;
сернокислого алюминия 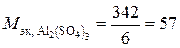 г/экв;
г/экв;
углерода в СО2, Н2СО3 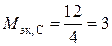 г/экв;
г/экв;
углерода в СО 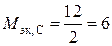 г/экв.
г/экв.
1.4. Моляльность раствора
Для упрощения аналитического описания зависимостей некоторых свойств растворов для определения концентрации растворенного вещества можно использовать моляльность – отношение числа молей растворенного вещества к массе (кг) растворителя
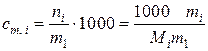 (моль/кг), (II.8)
(моль/кг), (II.8)
если m1 и mi – массы растворителя и растворенного вещества в граммах.
Для определения некоторых соотношений необходима дополнительная информация о плотности раствора r, г/см3.
В заключении отметим, что вышеприведенные концентрации не исчерпывают всех возможных способов определения составов растворов, определяемых их специфическими особенностями. Например, в экологии загрязненность воздуха часто определяется миллиграммами вредного вещества на кубический метр, измеренный при нормальных условиях, мг/нм3; загрязненность воды – в мг/л. Для определения концентрации газовых смесей и водных растворов иногда используется объемный процент (об.%). В металлургии сверхчистых металлов концентрация примесей определяется числом атомов примесного элемента на миллион атомов основного металла (ppm – particle per million).
