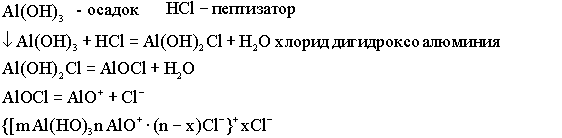Химические методы получения гидрофобных золей
Коллоидные системы по степени дисперсности занимают промежуточное положение между истинными растворами (молекулярно- или ионно-дисперсными системами) и грубодисперсными системами. Поэтому коллоидные растворы могут быть получены либо путем ассоциации (конденсации) молекул и ионов истинных растворов, либо дальнейшим раздроблением частиц дисперсной фазы грубодисперсных систем.
Методы получения коллоидных растворов также можно разделить на две группы: методы конденсации и диспергирования (в отдельную группу выделяется метод пептизации). Еще одним необходимым для получения золей условием, помимо доведения размеров частиц до коллоидных, является наличие в системе стабилизаторов – веществ, препятствующих процессу самопроизвольного укрупнения коллоидных частиц.
Дисперсионные методы основаны на раздроблении твердых тел до частиц коллоидного размера и образовании таким образом коллоидных растворов. Процесс диспергирования осуществляется различными методами: механическим размалыванием вещества в т.н. коллоидных мельницах, электродуговым распылением металлов, дроблением вещества при помощи ультразвука.
К конденсационным методам относят методы, основанные на следующих реакциях:
· обмена;
· гидролиза;
· окисления – восстановления.
После получения золей коллоидных растворов их необходимо очищать от электролитов, которые понижают их устойчивость и мешают изучению их свойств.
Очистку золей проводят методом диализа, а используемые для этого устройства называют диализаторами. В них имеется полупроницаемая перегородка, через которую проходят ионы и молекулы низкомолекулярных веществ, но задерживаются крупные по размеру коллоидные частицы. Для ускорения этого процесса применяют электрическое поле и устройства называются электродиализаторами.
Метод отделения дисперсной фазы от дисперсионной среды фильтрованием коллоидных растворов через полупроницаемые мембраны называется ультра-фильтрацией. Для этих целей используют также центрифуги и ультрацентрифуги
2.1. МЕТОД ИОННОГО ОБМЕНА
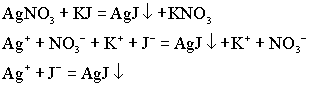
Если соли взять в эквивалентных количествах, то образуется истинный раствор, содержащий осадок иодида серебра.
Если эту же реакцию провести при избытке KJ, то после протекания реакции в растворе остаются ионы калия и йода.
В данном случае протекают одновременно два процесса. Образуются молекулы трудно растворимого вещества, которые собираются вместе, готовые выпасть в осадок.
Одновременно молекулы AgJ адсорбируют на своей поверхности ионы йода. Ионы йода притягивают к себе ионы противоположного знака, т.е. ионы калия. Состав мицеллы можно выразить формулой:
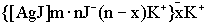 .
.
Потенциалобразующие ионы и противоионы образуют адсорбционный слой. Слово "адсорбционный" подчёркивает, что данные ионы прочно адсорбированы на поверхности ядра. Ядро с адсорбционным слоем образует гранулу мицеллы. Гранула мицеллы имеет заряд.
Остальные противоионы представляют собой диффузионный слой. Слово "диффузионный" говорит о том, что данные ионы связаны с ядром очень слабо, и данный слой является подвижным.
Целиком мицелла электронейтральна. Избыточный электролит (KJ) является стабилизатором. Стабилизирующую роль играют заряды диффузионного слоя.
МЕТОД ГИДРОЛИЗА
Реакция гидролиза солей железа:
Fe3+ + H2O ↔ [Fe(OH)]2+ + H+ ,
Fe3+ + 2H2O ↔ [Fe(OH)2]+ + 2H+ ,
Fe3+ + 3H2O ↔ Fe(OH)3 + 3H+ .
Полный гидролиз солей железа (III) протекает медленно и равновесие достигается за пять – шесть месяцев. Поэтому в золях гидроксида железа (III) формируются частицы переменного состава. В технологической практике часто используют соль железа (II) – железный купорос FeSO4·7H2O, гидролиз которого можно описать схемой
Fe2+ + 2H2O ↔ Fe(OH)2 + 2H+ .
Гидроксид железа (II) окисляется кислородом, растворенным в воде, в гидроксид железа (III):
4Fe(OH)2 + 2H2O + O2↔ 4Fe(OH)3 .
Гидроксид железа (II) Fe(OH)2 хорошо растворим в воде, поэтому для перевода его в гидроксид железа (III) требуется создавать щелочную среду, например, при использовании гидроксида кальция. Гидролиз ускоряется при нагревании. Мицелла гидроксида железа (III) может быть изображена схемой:
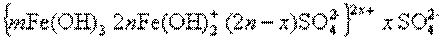
2.3. МЕТОДЫ ОКИСЛЕНИЯ И ВОССТАНОВЛЕНИЯ
Рассмотрим образование гидрофобного золя на основе окислительно - восстановительной реакции.
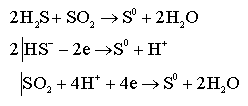
В данном случае ядром будет сера. Она имеет достаточно близкое химическое строение с анионом HS-, чтобы адсорбировать его на своей поверхности:
{[m S] n HS- (n –x )H +}-x H+
МЕТОД ПЕПТИЗАЦИИ
Пептизация - это перевод свежеполученного осадка в раствор.
Пептизация бывает двух видов:
· непосредственная;
· посредственная.
Непосредственной называется такая пептизация, при которой осадок и пептизатор имеет общий ион.
Осадок CuS можно пептизировать с помощью ионов меди или серы (Cu2+; S2-).
Пусть пептизатором служит Na2S:
{[m CuS ] nS2- 2 (n-x)Na+ }2- *2xNa+.
Посредственной называется такая пептизация, при которой осадок и пептизатор не имеют общих ионов, но взаимодействуют между собой химически.