Примеры решения типовых задач. Пример 1. Степень диссоциации уксусной кислоты в 0,1 М растворе равна 1,32∙10-2
Пример 1. Степень диссоциации уксусной кислоты в 0,1 М растворе равна 1,32∙10-2. Рассчитайте константу диссоциации уксусной кислоты.
Решение. Константу диссоциации уксусной кислоты определяем исходя из уравнения, отражающего закон разбавления Оствальда:
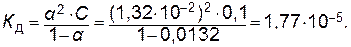
Пример 2. Рассчитайте молярную концентрацию раствора хлорида кальция, если известно, что степень диссоциации его в таком растворе равна 72%, а концентрация ионов хлора равна [Cl-]= 0,5 моль/л.
Решение. Хлорид кальция – соль, сильный электролит, диссоциирует по уравнению:
CaCl2 = Ca+ + 2Cl-.
Из уравнения диссоциации видно, что из одного моля хлорида кальция при диссоциации образуется два моля ионов хлора, следовательно, 0,5 молей Cl- образовалось при диссоциации 0,25 молей CaCl2, что составляет 72% от всего присутствующего в растворе количества хлористого кальция.
Следовательно, концентрация раствора хлорида кальция равна:
[CaCl2]= 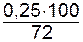 =0,347 моль/л.
=0,347 моль/л.
Пример 3. Произведение растворимости карбоната серебра Ag2CO3 при 25°С равно 6,15×10-12. Рассчитайте растворимость этого вещества и концентрации ионов [Ag+] и [СО32-] в насыщенном растворе.
Решение. Ag2CO3 диссоциирует по уравнению:
Ag2CO3 « 2Ag++ CO32-.
При диссоциации получается вдвое больше, чем ионов СО32-, а концентрация ионов [CO32-] равна концентрации молекул Ag2CO3 в
насыщенном растворе.
Выразим концентрации ионов серебра и карбоната через концентрацию соли Ag2CO3 в ее насыщенном растворе или, что то же самое, через растворимость соли (Ср), выраженную в моль/л:
[CO32-]=[Ag2CO3]=Ср(Ag2CO3); [Ag+]=2[Ag2CO3]=2Ср(Ag2CO3);
ПРAg2CO3=[Ag+]2∙[CO32-]=(2Ср)2×Ср=4Ср3.
Отсюда
Ср(Ag2CO3)= 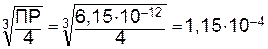 моль/л.
моль/л.
Ответ: [CO32-]= Ср(Ag2CO3)=1,15×10-4моль/л.
[Ag+]=2 Ср(Ag2CO3)=2×1,15×10-4=2,3×10-4моль/л.
Пример 4. Произведение растворимости сульфата кальция при 25°С равно 6,1×10-5. Определите, образуется ли осадок CaSO4 при смешении равных объемов раствора хлорида кальция с концентрацией [CaCl2]=0,1 моль/л и раствора сульфата натрия c концентрацией [Na2SO4]=0,01 моль/л.
Решение. Запишем уравнение реакции, протекающей при смешении указанных растворов:
CaCl2 + Na2SO4 = CaSO4↓+ 2NaCl,
Ca2+ + 2Cl- + 2Na+ + SO42- = CaSO4↓+ 2Na+ + 2Cl-,
Ca2+ + SO42- = CaSO4↓.
Произведение растворимости – характеристика насыщенного раствора малорастворимого электролита. Если произведение концентраций ионов [Са2+] и [SO42-] после смешения растворов, содержащих эти ионы, будет больше, чем ПРCaSO4, то раствор станет перенасыщенным и осадок выпадет. Если произведение концентраций ионов [Са2+] и [SO42-] в растворе меньше, чем ПРСaSO4, то раствор будет ненасыщенным и осадок не выпадет. При смешении равных объемов растворов объем смеси вдвое больше исходного, а концентрация каждого из растворенных веществ уменьшается вдвое, т.е. [CaCl2]=0,05 моль/л, а [Na2SO4]=0,005 моль/л. Концентрации ионов [Са2+] и [SO42-] соответственно равны: [Ca2+] = 0,05 моль/л, [SO42-] = 0,005 моль/л. Произведение концентраций ионов [Са2+] и [SO42-]
ПКCaSO4=[Ca2+]× [SO42-]=5×10-2´5×10-3=2,5×10-4;ПРCaSO4=6,1∙10-5.
Так как в рассматриваемом случае ПКCaSO4>ПРCaSO4 ,то осадок СаSO4 образуется.
Пример 5. Рассчитайте концентрацию ионов [Н+] и [ОН-] в растворе с рН=12,4. Определите характер среды.
Решение. По величине рН определяем концентрацию ионов водорода в растворе.
рН = – lg[H+],
lg[H+] = –12,4.
Следовательно: [H+]=10-12,4=10 0,6∙10-13 =3, 98∙10-13 моль/л.
Исходя из ионного произведения воды КН2О =[H+]×[OH- ]=10-14 находим [OH- ]= 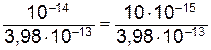 =2,5∙10-2=0,025 моль/л. Так как [ОН- ]>[H+], то раствор имеет щелочной характер (рН> 7).
=2,5∙10-2=0,025 моль/л. Так как [ОН- ]>[H+], то раствор имеет щелочной характер (рН> 7).
