Устойчивость комплексных соединений
Комплексные соединения – устойчивые химические соединения, в узлах кристаллической решетки которых находятся ионы, способные самостоятельно существовать в растворах.
В растворах комплексные соединения могут подвергаться первичной и вторичной диссоциации.
Первичная диссоциация комплексного соединения – это распад комплексного соединения в растворе на комплексный ион и ионы внешней сферы. В водных растворах первичная диссоциация комплексных соединений связана с разрывом в них ионной связи, и поэтому она практически необратима:
[Ag(NH3)2]Cl [Ag(NH3)2]+ + Cl–,
K4[Fe(CN)6] 4K+ + [Fe(CN)6]4–
Возникающий в результате первичной диссоциации комплексный ион ведет себя в растворе как целая самостоятельная частица с характерными для нее свойствами. Поэтому в водных растворах комплексных соединений, как правило, нельзя обнаружить присутствие ионов или молекул, входящих в состав внутренней сферы.Вторичная диссоциация комплексного соединения – это распад внутренней сферы комплекса на составляющие ее компоненты. Этот вид диссоциации комплексного соединения связан с разрывом ковалентной связи, поэтому вторичная диссоциация сильно затруднена и имеет ярко выраженный равновесный характер подобно диссоциации слабых электролитов:
1-я ступень [Ag(NH3)2]+ [Ag(NH3)]+ + NH3
2-я ступень [Ag(NH3)]+ Ag+ + NH3
Вторичная диссоциация, как всякий равновесный процесс, характеризуется константой равновесия. Для количественной характеристики устойчивости внутренней сферы комплексного соединения используют константу равновесия, описывающую полную диссоциацию внутренней сферы комплексного соединения, называемую константой нестойкости (неустойчивости).
Для комплексного иона [Ag(NH3)2]+ выражение константы нестойкости имеет вид:
[Ag(NH3)2]+ Ag+ +2NH3,
Чем меньше Кн., тем стабильнее комплексный ион, т.е. тем меньше он диссоциирует в водном растворе. Значение константы нестойкости зависит от природы комплексного соединения и свидетельствует о прочности связывания ионов в водных растворах (таблица 2).
Таблица 2
Константы нестойкости комплексных ионов.
| Комплексный ион | Кн. |
| [Ag(NH3)2]+ | 9,3∙10–8 |
| [Cu(NH3)4]2+ | 2,1∙10–13 |
| [Zn(OH)4]2– | 3,6∙10–16 |
| [Fe(CN)6]3– | 1,0∙10–31 |
| [Fe(CN)6]4– | 1,0∙10–36 |
§6. Химическая связь в комплексных соединениях.
Описание комплексных соединений с позиции теории валентных связей
В образовании химической связи во внутренней сфере комплексного соединения важнейшую роль играет донорно-акцепторное взаимодействие лигандов (доноры электронных пар) и комплексообразователя (акцептор).
При этом взаимодействии происходит образование ковалентной химической связи, что определяет строго определенное пространственное расположение лигандов вокруг комплексообразователя и достаточно высокую устойчивость к диссоциации комплексного иона.
Комплексообразователь (атом или катион металла) предоставляет свободные орбитали внешних электронных слоев, которые гибридизуясь, т.е. выравниваясь по энергии и форме, располагаются в пространстве определенным образом. Это и создает структуру внутренней сферы комплекса, которая определяется типом гибридизации исходных свободных атомных орбиталей комплексообразователя (таблица 3). Ионы внешней сферы связаны с комплексным ионом посредством ионной связи.
Таблица 3
Тип гибридизации комплексообразователя и структура внутренней сферы комплексного соединения.
| К.Ч. | Тип гибридизации | Геометрия расположения связей | Структура | Пример комплексного соединения |
| sp | L – M – L | линейная | [Ag(NH3)2]+ | |
| sp3 | 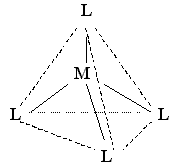 | тетраэдрическая | [BF4]– [Ni(NH3)4]2+ | |
| sp2d | 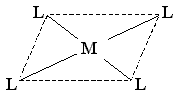 | квадратно-плоскостная | [Сu(NH3)4]2+ [Pt(NH3)2Cl2] | |
| sp3d2, (d2sp3) | 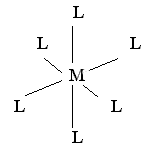 | октаэдрическая | [Fe(CN)6]3+ [Fe(CN)6]4+ |
Для объяснения образования и свойств комплексных соединений применяют ряд теорий, в том числе и теорию строения валентных связей. Образование комплексов теория валентных связей относит за счет донорно-акцепторного взаимодействия комплексообразователя и лигандов.
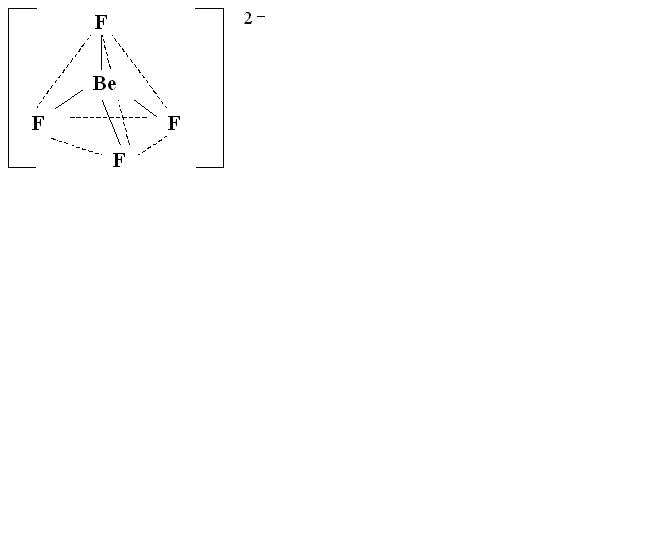
Так, строение тетраэдрического иона [BeF4]2– можно рассмотреть следующим образом:
Электронное строение комплексообразователя – иона бериллия:
Be 2s22p0 Be2+ 2s02p0
s p
Электронное строение лигандов – отрицательно заряженных ионов фтора:
F 2s22p5 F- 2s22p
s p
Электронное строение комплексообразователя и лигандов показывает, что комплексообразователь способен предоставить свободные орбитали для образования связи по донорно-акцепторному механизму, а лиганды имеют неподеленные пары электронов, т.е. могут быть донорами электронных пар.
Координационное число комплексного иона равно 4, такое же число вакантных орбиталей комплексообразователя должно принять участие в процессе гибридизации, следовательно, тип гибридизации комплексообразователя – sp3, что обуславливает его геометрию в пространстве – тетраэдрическое строение (рисунок 8.2).
Рисунок 8.2.
Пространственная структура комплексного иона.