Устойчивость комплексных соединений. Константа нестойкости
В растворах комплексных соединений существует система динамических равновесий, т. е. комплексные соединения подвержены в значительной степени электролитической диссоциации. Ионы или молекулы, находящиеся во внешней сфере, связаны в комплексном соединении гораздо слабее, чем ионы или молекулы, находящиеся во внутренней сфере. Такая различная прочность связи обусловливает характер диссоциации комплексных соединений.
Диссоциация комплексных соединений протекает по стадиям. На первой стадии комплексное соединение диссоциирует как сильный электролит, т. е. практически полностью. Далее, комплексный ион диссоциирует как слабый электролит по ступеням, т. е. лиганды отделяются от комплексообразователя постепенно. Например, диссоциация комплексной соли [Ag(NH3)2]Cl протекает по следующим стадиям:
Первая стадия: [Ag(NH3)2]Cl 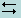 [Ag(NH3)2]+ + Cl-
[Ag(NH3)2]+ + Cl-
Вторая стадия:1. Ag(NH3)2]+ 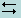 AgNH3+ + NH3
AgNH3+ + NH3
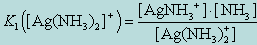
2. AgNH3+ 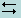 Ag+ + NH3
Ag+ + NH3
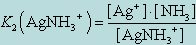
Диссоциация комплекса идет лишь в незначительной степени и может быть охарактеризована величиной общей константы ионизации данного комплекса, которая определяется как произведение констант диссоциации по отдельным ступеням. Так, в данном примере
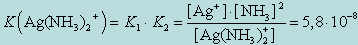 (9.1)
(9.1)
Чем больше величина этой константы, тем сильнее комплекс диссоциирует, тем менее он устойчив. Эта константа называется константой нестойкости. Обратная величина константы нестойкости называется константой устойчивости :
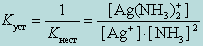 (9.2)
(9.2)
Константы нестойкости для различных комплексных ионов различны и могут служить мерой устойчивости комплекса. Наиболее устойчивые в растворах комплексные ионы имеют наименьшие константы нестойкости. Так, среди соединений
| [Ag(NO2)2] - | [Ag(NH3)2] + | [Ag(S2O3)] - | [Ag(CN)2] - | |
| K нест | 1,3 · 10-3 | 5,8 · 10 -8 | 1,5 · 10 -9 | 1,4 · 10-20 |
устойчивость комплекса возрастает при переходе от [Ag(NO2)2] - к [Ag(CN)2] -.
Значения констант нестойкости и устойчивости приводятся в справочниках по химии. С помощью этих величин можно предсказать течение реакций между комплексными соединениями: при сильном различии констант устойчивости реакция пойдет в сторону образования комплекса с большей константой устойчивости или, что равноценно, с меньшей константой нестойкости. Например, для иона [Ag(NH3)2] + Kнест = 5,8 · 10 -8, а для иона [Ag(CN)2] - Kнест = 1,4 · 10 -20, поэтому при действии раствора КСN аммиакат серебра разрушается с образованием иона [Ag(CN)2] - :
[Ag(NH3)2]Cl = 2KCN = K[Ag(CN)2] + 2NH3 = KCl
Зная константы нестойкости различных комплексов, можно теоретически вычислить концентрацию соответствующих простых ионов в растворах комплексных солей.
Пример 1.
Найти концентрацию Ag+ в 0,01 М растворе [Ag(NH3)2]NO3, если Kнест = 5,8 · 10 - 8.
Решение.
Обозначив искомую концентрацию Ag+ через х, из уравнения диссоциации комплекса [Ag(NH3)2]+ находим
[NH3] = 2x; 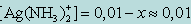
т. к. степень диссоциации комплекса незначительна. Следовательно, можно записать
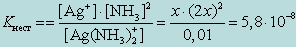
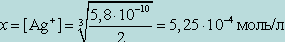
От величины Kнест комплексного иона и KS осадка, который образует реактив с одним из продуктов распада комплекса, зависит, будут ли образовываться соответствующие осадки.
Пример 2.
Образуется ли осадок AgCl при прибавлении к 0,01М раствору [Ag(NH3)2]NO3 0,01М раствора KСl?
KS(AgCl) = 1,8 · 10 -10; Kнест[Ag(NH3)+2] = 5,8 10 -8.
Решение.
[ Ag+] = 5,25 ·10 -4 моль/л (см. пример 1), исходя из условия [Cl]- = 0,01 моль/л.
Для того чтобы выпал осадок AgCl, необходимо, чтобы
[ Ag+] · [Cl-]>KS(AgCl)
В данном примере
5,25 · 10 -4 · 10-2 = 5,25 · 10 -6 > 1,8 · 10 -10
Следовательно, осадок AgCl образуется.
При выборе условий наиболее эффективного разделения ионов исходят из соотношения констант устойчивости образуемых ими комплексных соединений.
Например, катионы Ni2+, Co2+, Zn2+ дают устойчивые растворимые аммиакаты, а Al3+, Fe3+, Cr3+ менее склонны к комплексообразованию с аммиаком и осаждаются при действии аммиака в виде гидроксидов. Это позволяет разделить действием аммиака эти две группы катионов.
3)
| Окислительно-восстановительные реакции |
| Основные понятия Окислительно-восстановительные реакции сопровождаются переходом электронов от одних участвующих в реакции частиц (атомов, ионов, молекул) к другим. Процесс потери электронов частицей называется ее окислением, а сама частица, теряющая электроны, -восстановителем. Процесс присоединения электронов частицей называется ее восстановлением, а сама частица, принимающая электроны, - окислителем. Таким образом, в ходе окислительно-восстановительной реакции окислитель восстанавливается, а восстановитель окисляется. В химических реакциях окисление одного вещества всегда сопровождается восстановлением другого, и наоборот. Количество электронов, принимаемых окислителем, равно количеству электронов, теряемых восстановителем, поэтому химическая система в целом остается электронейтральной. Это означает, что если мы нашли в уравнении реакции вещество, которое в ходе реакции, например, восстанавливается, то следует искать в том же уравнении вещество, которое в ходе реакции окисляется, и наоборот. Степень окисления – формальная величина, которую вычисляют на основе формулы соединения исходя из условного допущения, что связь между атомами в данном соединении ионная. Несмотря на формальный характер понятия «степень окисления», использование его оказывается весьма продуктивным при рассмотрении окислительно-восстановительных реакций, в частности при нахождении коэффициентов уравнений окислительно-восстановительных реакций. Так как электрон заряжен отрицательно, при окислении степень окисления атома изменяется в положительную сторону, а при восстановлении – в отрицательную. При образовании химической связи между двумя разными атомами во многих случаях происходит не переход электронов, а лишь некоторое смещение электронного облака валентных электронов от одного атома к другому. В высших степенях окисления все атомы вообще склонны образовывать соединения с ковалентной связью, а не ионной. Так, в ионе MnO4¯ связь между атомами кислорода и марганца ковалентная полярная, и заряд на атоме марганца отнюдь не +7 (как формальная степень окисления), а во много раз меньше. Говоря, что степень окисления марганца в таком ионе численно равна +7 и что при восстановлении этого иона до марганца в степени окисления +2 атом марганца принимает пять электронов, мы допускаем очень большую условность. правильнее говорить, что ион MnO4¯ превращается в ион Mn2+ , совершенно не касаясь при этом вопроса о том, какие заряды имеются на атомах марганца и кислорода в ионе MnO4¯. Количество электронов, которое переходит от восстановителя к окислителю при таком превращении, также равно пяти – в этом мы сможем убедиться чуть позже. Таким образом, применяя заведомо условный формальный подход (степень окисления), мы получаем верный количественный результат (количество электронов, получаемых окислителем от восстановителя). Типы окислительно-восстановительных реакций Окислительно-восстановительные реакции можно разделить на три типа: межмолекулярные, внутримолекулярные и реакции диспропорционирования (самоокисления - самовосстановления). Межмолекулярными называются окислительно-восстановительные реакции, в результате которых изменяется степень окисления атомов в разных веществах. Таким образом, в роли окислителя и восстановителя в этом случае выступают разные вещества. Например: 2Ca + O2 = 2CaO Такие окислительно-восстановительные реакции встречаются чаще всего. Окислительно-восстановительные реакции, в результате которых меняется степень окисления разных атомов в одном и том же веществе, называются внутримолекулярными. В этом случае в роли окислителя и восстановителя выступают разные атомы в одном и том же соединении. Например: 2KClO3 = 2KCl + 3O2 Здесь хлор восстанавливается, а кислород окисляется. Окислительно-восстановительные реакции, в ходе которых одновременно понижается и повышается степень окисления одного и того же элемента, называются реакциями диспропорционирования (дисмутации). В таких реакциях в роли окислителя и восстановителя выступают атомы одного и того же элемента. Например: 4KClO3 = KCl + 3KClO4 Реакции диспропорционирования возможны, когда в исходном веществе элемент имеет промежуточную степень окисления. Обратные реакции, в результате которых из двух степеней окисления одного элемента образуется новая степень окисления, промежуточная между исходными, называются реакциями конпропорционирования (конмутации). Вместо термиров «диспропорционирование» и «конпропорционирование» употребляют также термин «самоокисление-самовосстановление». Пример 1. Исходя из степени окисления (n)азота, серы и марганца в соединениях NH3, HNO2, HNO3, H2S, H2SO3, H2SO4, MnO2, KMnO4, определите, какие из них могут быть только восстановителями, только окислителями и какие проявляют как окислительные, так и восстановительные свойства. Решение.Степень окисления азота в указанных соединениях соответственно равна: –3 (низшая), + 3 (промежуточная), +5 (высшая); n(S) соответственно равна: –2 (низшая), +4 (промежуточная), +6 (высшая); n(Мn) соответственно равна: +4 (промежуточная), +7 (высшая). Отсюда: NH3, H2S – только восстановители; HNO3, H2SO4, KMnO4 – только окислители; HNO2, H2SO3, MnO2 – окислители и восстановители. |
4)Произведение растворимости (ПР, Ksp) — произведение концентрации ионов малорастворимого электролита в его насыщенном растворе при постоянной температуре и давлении. Произведение растворимости — величина постоянная.
При постоянной температуре в насыщенных водных растворах малорастворимых электролитов устанавливается равновесие между твердым веществом и ионами, образующими это вещество. Например, в случае для CaCO3 это равновесие можно записать в виде:
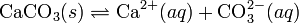
Константа этого равновесия рассчитывается по уравнению:
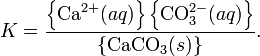
В приближении идеального раствора с учетом того, что активность чистого компонента равна единице, уравнение упрощается до выражения:
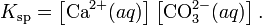
Константа равновесия такого процесса называется произведением растворимости.
В общем виде, произведение растворимости для вещества с формулой AmBn, которое диссоциирует на m ионов An+ и n ионов Bm-, рассчитывается по уравнению:
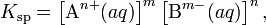
где [An+] и [Bm-] — равновесные молярные концентрации ионов, образующихся при электролитической диссоциации.
Из произведений растворимости можно рассчитать концентрации катионов и анионов в растворе малорастворимого электролита. Значения произведений растворимости приведены в справочниках.
Произведение активностей
Данное уравнение не учитывает коэффициенты активности, то есть степень влияния ионных сил. Для растворов с концентрациями большими, чем 1×10−4 моль/л необходимо использовать произведение активностей:
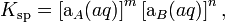
где аA и аB — активности ионов A и B.
Произведение активностей ионов для насыщенных растворов малорастворимых электролитов при данной температуре постоянная величина. Она зависит от температуры и природы растворителя.
Произведение растворимости связано с растворимостью следующим соотношением:
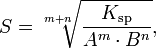
где:
m+n — суммарное количество молей катионов и анионов
m — количество молей катиона
n — количество молей аниона
Ksp — произведение растворимости
S — растворимость вещества (моль/л)
Растворимость, способность вещества образовывать с другим веществом однородную, термодинамически устойчивую систему переменного состава, состоящую из двух или большего числа компонентов. Такие системы возникают при взаимодействии газов с жидкостями, жидкостей с жидкостями и т.д. (см. Растворы).Соотношение компонентов может быть либо произвольным, либо ограниченным некоторыми пределами. В последнем случае Р. называют ограниченной. Мерой Р. вещества при данных условиях служит концентрация его насыщенного раствора. Р. различных веществ в определённомрастворителе зависит от внешних условий, прежде всего — от температуры и давления. Давление наиболее сильно сказывается на Р. газов. Изменение внешних условий влияет на Р. в соответствии с принципом смещения равновесий (см. Ле Шателье — Брауна принцип).Для наиболее важных растворителей составлены таблицы Р. различных веществ в зависимости от внешних условий или только для стандартных условий.
ПЯТЫЙ
Спектральный анализ — совокупность методов качественного и количественного определения состава объекта, основанная на изучении спектров взаимодействия материи с излучением, включая спектры электромагнитного излучения, акустических волн, распределения по массам и энергиям элементарных частиц и др. В зависимости от целей анализа и типов спектров выделяют несколько методов спектрального анализа. Атомный и молекулярный спектральный анализы позволяют определять элементный и молекулярный состав вещества, соответственно. В эмиссионном иабсорбционном методах состав определяется по спектрам испускания и поглощения. Масс-спектрометрический анализ осуществляется по спектрам масс атомарных или молекулярных ионов и позволяет определять изотопный состав объекта.
Принцип работы
Атомы каждого химического элемента имеют строго определённые резонансные частоты, в результате чего именно на этих частотах они излучают или поглощают свет. Это приводит к тому, что вспектроскопе на спектрах видны линии (тёмные или светлые) в определённых местах, характерных для каждого вещества. Интенсивность линий зависит от количества вещества и его состояния. В количественном спектральном анализе определяют содержание исследуемого вещества по относительной или абсолютной интенсивностям линий или полос в спектрах.
Оптический спектральный анализ характеризуется относительной простотой выполнения, отсутствием сложной подготовки проб к анализу, незначительным количеством вещества (10—30 мг), необходимого для анализа на большое число элементов. Атомарные спектры (поглощения или испускания) получают переведением вещества в парообразное состояние путём нагревания пробы до 1000—10000 °C. В качестве источников возбуждения атомов при эмиссионном анализе токопроводящих материалов применяют искру, дугу переменного тока; при этом пробу помещают в кратер одного из угольных электродов. Для анализа растворов широко используют пламя или плазму различных газов.
ПрименениеВ последнее время, наибольшее распространение получили эмиссионные и масс-спектрометрические методы спектрального анализа, основанные на возбуждении атомов и их ионизации в аргоновойплазме индукционных разрядов, а также в лазерной искре. Спектральный анализ — чувствительный метод и широко применяется в аналитической химии, астрофизике, металлургии, машиностроении,геологической разведке и других отраслях науки.В теории обработки сигналов, спектральный анализ также означает анализ распределения энергии сигнала (например, звукового) по частотам, волновым числам и т. п.
