Принципы количественного определения активности ферментов
Ферменты
 Основу всех жизненных процессов составляют тысячи химических реакций, катализируемых ферментами. Значение ферментов точно и образно определил И.П.Павлов, назвав их «возбудителями жизни». Нарушения в работе ферментов ведут к возникновению тяжелых заболеваний (фенилкетонурия, гликогенозы, галактоземия, тирозинемия) или существенному снижению качества жизни (дислипопротеинемии, гемофилии).
Основу всех жизненных процессов составляют тысячи химических реакций, катализируемых ферментами. Значение ферментов точно и образно определил И.П.Павлов, назвав их «возбудителями жизни». Нарушения в работе ферментов ведут к возникновению тяжелых заболеваний (фенилкетонурия, гликогенозы, галактоземия, тирозинемия) или существенному снижению качества жизни (дислипопротеинемии, гемофилии).
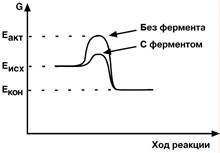
Известно, что для осуществления химической реакции необходимо, чтобы реагирующие вещества имели суммарную энергию выше, чем величина, называемая энергетическим барьером реакции. Для характеристики величины энергетического барьера Аррениус ввел понятие энергии активации. Преодоление энергии активации в химической реакции достигается либо увеличением энергии взаимодействующих молекул, например нагреванием, облучением, повышением давления, либо снижением требуемых для реакции затрат энергии (т.е. энергии активации) при помощи катализаторов.
По своей функции ферменты являются биологическими катализаторами. Сущность действия ферментов, так же как неорганических катализаторов, заключается:
1) в активации молекул реагирующих веществ
2) в разбиении реакции на несколько этапов, энергетический барьер каждого из которых ниже такового исходной реакции.
N.B. Однако энергетически невозможные реакции ферменты катализировать не будут, они ускоряют только те реакции, которые могут идти самопроизвольно в данных условиях.
Этапы ферментативного катализа
1. Присоединение субстрата к ферменту
2.  Преобразование фермент-субстратного комплекса в один или несколько переходных комплексов за одну или несколько стадий.
Преобразование фермент-субстратного комплекса в один или несколько переходных комплексов за одну или несколько стадий.
3. Превращение переходного комплекса в комплекс фермент-продукт.
4. Отделение конечных продуктов от фермента.
Механизмы катализа
| 1. Кислотно-основной катализ – в активном центре фермента находятся группы специфичных аминокислотных остатков, которые являются хорошими донорами или акцепторами протонов. Такие группы представляют собой мощные катализаторы многих органических реакций. | Доноры | Акцепторы | |
| –СООН –NH3+ –SH | –СОО– –NH2 –S– |
2. Ковалентный катализ – ферменты реагируют со своими субстратами, образуя при помощи ковалентных связей очень нестабильные фермент-субстратные комплексы, из которых в ходе внутримолекулярных перестроек образуются продукты реакции.
Сходство и отличия ферментов и
неорганических катализаторов
| Сходство | Отличия |
| 1) Катализируют только энергетически возможные реакции. 2) Не изменяют направления реакции. 3) Ускоряют наступление равновесия реакции, но не сдвигают его. 4) Не расходуются в процессе реакции. | 1) Скорость ферментативной реакции намного выше. 2) Высокая специфичность. 3) Мягкие условия работы (внутриклеточные). 4) Возможность регулирования скорости реакции. 5) Скорость ферментативной реакции пропорциональна количеству фермента. |
Дополнение
Ускорение реакций при помощи ферментов может быть весьма значительным:
Рассмотрим реакцию восстановления пероксида водорода:
Н2О2 ® О2 + 2Н2О2
Если скорость без катализатора принять за единицу, то в присутствии платиновой черни скорость реакции увеличивается в 2*104 раза, а энергия активации снижается с 18 до 12 ккал/моль, а в присутствии фермента каталазы скорость реакции возрастает 2*1011 раза с энергией активации 2 ккал/моль.
| Скорость реакции, отн.ед. | Энергия активации, ккал/моль | |
| Без катализатора | 1 | 18 |
| С платиновой чернью | 2´104 | 12 |
| С ферментом каталаза | 2´1011 | 2 |
Строение ферментов
Давно выяснено, что все ферменты являются белками и обладают всеми свойствами белков.
1. Подобно белкам они делятся на простые и сложные.
Простые состоят только из аминокислот – например, пепсин, трипсин, лизоцим.
Сложные ферменты имеют в своем составе белковую часть, состоящую из аминокислот – апофермент, и небелковую часть – кофактор. Обычно кофактор называется коферментом, если он легко отделяется от апобелка, но если он связан с белком прочно, то называется простетической группой.
2. Как многие белки, ферменты могут быть мономерами, т.е. состоят из одной субъединицы, и полимерами, состоящими из нескольких субъединиц.
 N.B. Для осуществления катализа необходим комплекс апобелка и кофактора, по отдельности они катализ осуществить не могут.
N.B. Для осуществления катализа необходим комплекс апобелка и кофактора, по отдельности они катализ осуществить не могут.
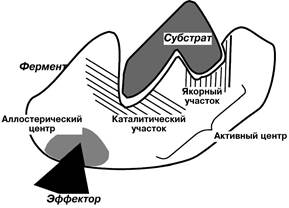
В составе фермента выделяют несколько участков, выполняющих различную функцию.
1. Активный центр – комбинация аминокислотных остатков, обеспечивающая непосредственное связывание с молекулой субстрата и осуществляющая катализ. Аминокислотные радикалы в активном центре могут находиться в любом сочетании. При разворачивании пептидной цепи аминокислоты активного центра значительно удаляются друг от друга.
У сложных ферментов в активном центре обязательно расположены функциональные группы кофактора.
В свою очередь в активном центре выделяют два участка:
· якорный (контактный, связывающий) – отвечает за связывание и ориентацию субстрата в активном центре
· каталитический – непосредственно отвечает за осуществление реакции.
2. Аллостерический центр (allos - чужой) –центр регуляции активности фермента, пространственно отделен от активного, имеется не у всех ферментов. Связывание с ним какой-либо молекулы (называемой активатором или ингибитором, а также эффектором, модулятором, регулятором) вызывает изменение конфигурации белка и, как следствие, скорости ферментативной реакции. В качестве такого регулятора чаще всего выступает продукт данной или одной из последующих реакций. Аллостерические ферменты являются полимерами и их активный и регуляторный центры находятся в разных субъединицах.
Принципы количественного определения активности ферментов
1. Активность фермента выражается в скорости накопления продукта или скорости убыли субстрата в пересчете на количество материала, содержащего фермент.
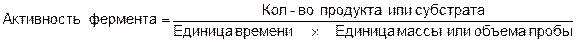
Например, известно, что 1 г пепсина расщепляет 50 кг яичного белка за один час. Таким образом, его активность составит 50 кг/час на 1 г фермента.
Если количество слюны в 1,6 г расщепляет 175 кг крахмала в час, значит, активность амилазы слюны составит 109,4 кг крахмала в час на 1 г слюны.
На занятиях в качественных реакциях активность амилазы можно исследовать и по количеству образованной глюкозы, при этом появляется красное окрашивание в реакции Фелинга.
2. Создание стандартных условий, чтобы можно было сравнивать результаты полученные в разных лабораториях – температура 25°С и оптимальная рН;
3. Избыток субстрата, чтобы работали все имеющиеся в растворе молекулы фермента;
Свойства ферментов
