Дезаминирование аминокислот
Глава 6. Белковый обмен

Раздел 1. Значение изучаемой темы
В количественномотношении белки занимают первое место среди всех содержащихся в живой клетке макромолекул.Велико также их разнообразие; в одной клетке можно обнаружить сотни различных видов белков. Выполняя ряд уникальных функций, белки определяют не только микро- и макроструктуру отдельных субклеточных образований, специфику клеток, органов и целого организма, но и, в значительной степени, динамическое состояние между организмом и окружающей средой.
Белковый обмен строго специфичен, обеспечивая непрерывность воспроизводства и обновления белковых тел в организме. Помимо пластической функции, белки выполняют уникальную каталитическую функцию, белками также являются многие гормоны. Таким образом, именно белковый обмен координирует, регулирует и интегрирует многообразие химических превращений в организме, подчиняя его задачам сохранения вида, обеспечивая тем самым непрерывность жизни.
Состояние белкового обмена определяется множеством факторов, как экзогенных (окружающая среда, характер питания и др.), так и эндогенных (физиологическое состояние организма, включающее нейрогуморальный статус и др.). Любые отклонения от нормального физиологического состояния организма отражаются на азотистом обмене. Знание закономерностей изменений обмена белков при данном конкретном патологическом процессе – необходимая предпосылка для правильного выбора тактики терапевтических мероприятий по устранению нарушенного процесса обмена.
Знания, полученные при изучении данного раздела биохимии, будут востребованы на всех кафедрах и в будущей врачебной деятельности.
Раздел 2. Сведения о белковом обмене
Функции белков
- ферментативная;
- структурообразовательная;
- защитная (иммунная);
- опорная;
- сократительная;
- регуляторная (гормоны, рецепторы);
- энергетическая
- транспортная (белки плазмы крови, белки мембран, белки плазматических мембран, белки каналов);
- специфические функции.
Переваривание белков
Переваривание белковосуществляется пептидазами. Пептидазы являются ферментами класса гидролаз, расщепляют пептидные связи. Различают эндо- и экзопептидазы. Эндопептидазы расщепляют внутренние пептидные связи, к ним относятся пепсин и гастриксин желудка, трипсин, химотрипсин, коллагеназа и эластаза поджелудочной железы, энтеропептидаза кишечника. Экзопептидазы расщепляют внешние пептидные связи, к ним относятся карбоксипептидаза поджелудочной железы, аминопептидаза и олигопептидазы кишечника.
Все пептидазы образуются в неактивной форме и активируются путем ограниченного протеолиза в тех местах, где они действуют.
Характеристика пептидаз
Пепсин образуется главными клетками желудка в виде препепсина. Перевод препепсина в пепсин происходит путем отщепления 42 аминокислотных остатков. Процесс начинается под воздействием протонов водорода и идет медленно, а затем каждая активная молекула пепсина действует на неактивные молекулы, и этот процесс идет быстро. Таким образом, за короткое время в желудке образуется много активных молекул пепсина, которые расщепляют связи, образованные карбоксильными группами ароматических аминокислот (фенилаланина, тирозина и триптофана). Пепсин действует в сильно кислой среде при рН 1,5 - 2,5.
Гастриксинобразуется в желудке, расщепляет связи, образованные карбоксильными группами дикарбоновых аминокислот (глутамата и аспартата), действует при рН 3,5.
Трипсин образуется в поджелудочной железе в виде претрипсина. Активируется под действием энтеропептидазы кишечника путем отщепления 6 аминокислот. Трипсин расщепляет связи, образованные карбоксильными группами аргинина или лизина. Под воздействием трипсина переходят в активное состояние другие пептидазы.
Химотрипсин образуется в поджелудочной железе в виде прехимотрипсина. Активируется под действием трипсина. Расщепляет связи, образованные карбоксильными группами ароматических аминокислот.
Эластаза образуется в поджелудочной железе, расщепляет связи образованные пролином.
Коллагеназа образуется в поджелудочной железе, расщепляет коллаген.
Карбоксипептидаза образуется в поджелудочной железе в неактивной форме, активируется трипсином, отщепляет аминокислоты с С-конца, то есть является экзопептидазой.
Аминопептидаза образуется в кишечнике, отщепляет аминокислоты с N-конца.
Дипептидазы образуются в кишечнике и расщепляют дипептиды.
В результате действия вышеперечисленных пептидаз белки расщепляются до аминокислот, которые всасываются стенкой кишечника путем активного транспорта с использованием специфических переносчиков, витамина В6 и АТФ. Через воротную вену аминокислоты попадают в печень, которая обладает наибольшей способностью поглощать аминокислоты из крови, весьма активны в этом отношении почки. Головной мозг поглощает аминокислоты избирательно. Часть аминокислот не всасывается и подвергается действию кишечной микрофлоры.
Роль НСl
- необходима для превращения препепсина в пепсин;
- создает оптимум рН для работы пепсина;
- способствует денатурации и набуханию пищевых белков;
- обладает бактерицидным действием, то есть препятствует развитию микрофлоры.
Соляная кислота образуется обкладочными клетками желудка. В добавочных клетках желудка образуется слизь, содержащая гликопротеиды. Слизь препятствует самоперевариванию желудка.
Регуляция выработки пищеварительных соков
Соки желудка:
· Ацетилхолин, освобождающийся при раздражении блуждающего нерва, приводит к секреции гистамина, который через Н2-рецепторы стимулирует секрецию НСl.
· Гастрин, пептидный гормон желудка, вызывает выделение желудочного сока.
· Энтерогастрон,гормон 12-перстной кишки, тормозит секрецию НСl и препепсина в желудке.
Поджелудочные соки:
· Секретин, пептидный гормон 12-перстной кишки, стимулирует выделение поджелудочного сока, содержащего много воды и гидрокарбонатов, но обедненного ферментами.
· Ацетилхолин стимулирует секрецию поджелудочного сока, богатого ферментами.
· Холецистокинин,пептидный гормон 12-перстной кишки, усиливает секрецию сока поджелудочной железы, обогащенного ферментами.
· ГКС усиливают секрецию всех пищеварительных соков (и желудка, и поджелудочной железы), но снижает выделение слизи.
Источники аминокислот
1. Переваривание пищевых белков в ЖКТ.
2. Расщепление клеточных белков лизосомальными пептидазами (катепсинами).
3. Синтез из других аминокислот.
4. Образование из безазотистых соединений (прежде всего из кетокислот).
Пути использования аминокислот
1. Синтез белков (это основной путь использования аминокислот).
2. Синтез биологически важных соединений (пуринов, пиримидинов, гормонов, порфиринов и других).
3. Дезаминирование аминокислот с образованием кетокислот, которые могут:
- окисляться в цикле Кребса,
- использоваться в ГНГ на синтез глюкозы,
- превращаться в кетоновые тела.
Декарбоксилирование аминокислот
Декарбоксилирование аминокислот-это отщепление от аминокислоты карбоксильной группы. Процесс катализируется декарбоксилазами, в состав которых входит витамин В6. В большинстве случаев при декарбоксилировании аминокислот образуются амины (исключением является глутамат, при декарбоксилировании которого образуется g-аминомасляная кислота).
Примеры реакций декарбоксилирования и функции образовавшихся продуктов:
1. При декарбоксилировании орнитина образуется путресцин, лизина - кадаверин (уравнение реакции смотрите в приложении или учебнике). Эти амины образуются при бактериальном брожении из белков и давно известны из-за неприятного запаха. Раньше их считали трупными ядами, хотя это не так. Из них образуются полиамины. Из путресцина образуются спермин и спермидин, которые стабилизируют структуру мембран. Спермидин прочно связан с ДНК и может способствовать стабилизации ее структуры.
2. При декарбоксилировании серина образуется этаноламин, который путем метилирования превращается в холин. Холин и этаноламин входят в сос-тав сложных липидов. Из холина путем ацетилирования образуется ацетилхолин.
3. При декарбоксилировании цистеина образуется меркаптоэтиламин, который входит в состав КоА. Меркаптоэтиламин является радиопротектором.
4. Таурин образуется при декарбоксилировании цистеиновой кислоты и входит в состав таурохолевой кислоты (желчная кислота) и является нейрорегулятором.
5. При декарбоксилировании гистидина образуется гистамин, который:
а) через Н2-рецепторы усиливает секрецию НСl в желудке,
б) через Н1-рецепторы снижает артериальное давление в результате
расширения мелких сосудов и увеличения их проницаемости,
в) участвует в аллергических и анафилактических реакциях.
6. При декарбоксилировании триптофана образуется триптамин, при де-
карбоксилировании 5-гидрокситриптофана образуется серотонин. Оба амина являются регуляторами.
Дезаминирование аминокислот
Дезаминирование аминокислот - это процесс отщепления от аминокислоты аминогруппы. Различают несколько типов дезаминирования: окислительное, внутримолекулярное, восстановительное и гидролитическое. В организме человека имеет место окислительное дезаминирование. Для большинства аминокислот (кроме глутамата) оно протекает непрямо, вначале происходит переаминирование с образованием глутаминовой кислоты, которая, на втором этапе, подвергается окислительному дезаминированию. Для треонина и лизина дезаминирование происходит другим путем.
Переаминирование (трансаминирование) аминокислот
Этот процесс был открыт Браунштейном и Крицман в 1937 г. Реакция катализируется аминотрансферазами, в состав которых входит витамин В6. В переаминировании участвуют аминокислота и кетокислота (чаще 2-оксоглутарат, реже - пируват и оксалоацетат). В результате реакции образуются новая аминокислота и новая кетокислота.
Значение реакции переаминирования
1. Коллекторная функция, то есть аминогруппы от многих аминокислот собираются в одной форме в виде глутамата;
2. Является источником заменимых аминокислот;
3. В ходе этой реакции аминокислоты превращаются в кетокислоты, которые могут окисляться в цикле Кребса, использоваться в ГНГ или превращаться в кетоновые тела. Аминокислоты, которые в ходе метаболизма превращаются в углеводы, называются гликогенными. Таких аминокислот 15. Аминокислоты, которые в ходе своего метаболизма превращаются в кетоновые тела, называются кетогенными. Такой аминокислотой является лейцин. Аминокислоты, которые в ходе метаболизма дают углеводы и кетоновые тела, называются смешанными. Такими аминокислотами являются фенилаланин, тирозин, триптофан, лизин.
4. Аминотрансферазы - это универсальные ферменты, которые имеются в каждой клетке. В крови их очень мало. Увеличение активности аминотрансфераз свидетельствует о разрушении тех клеток, где они находились. Этот факт используется для диагностики некоторых заболеваний. Так, при инфаркте миокарда в крови увеличивается активность аспартатаминотрансферазы, а при вирусном гепатите или циррозе печени увеличивается активность аланинаминотрансферазы.
Аминотрансферазы активируются катехоламинами, глюкокортикостероидами, большими дозами йодтиронинов.
Окислительное дезаминирование глутаминовой кислоты
Происходит в митохондриях под влиянием глутаматдегидрогеназы (ГДГ). ГДГ является высокоактивным ферментом, ее тормозит АТФ, активирует АДФ. Продуктами глутаматдегидрогеназной реакции являются 2-оксоглутарат, NH3 и НАДН.
2-оксоглутарат окисляется в цикле Кребса, НАДН - в дыхательной цепи с выделением 3 АТФ, аммиак обезвреживается.
ГДГ-реакция имеет энергетическое значение. Она особенно важна в головном мозге, так как в аварийных ситуациях поставляет энергию: например, при гипогликемии.
Восстановительное аминирование
Восстановительное аминирование - это реакция присоединения аммиака к 2-оксоглутарату с последующим восстановлением образующегося продукта. Донором водорода в этой реакции является НАДФН. Реакцию катализирует глутаматдегидрогеназа.
Значение восстановительного аминирования:
- является источником заменимых аминокислот;
- служит одним из способов связывания аммиака в клетке.
Источники аммиака и пути его обезвреживания
Аммиак образуется в результате реакций дезаминирования аминокислот, биогенных аминов (гистамина, серотонина, катехоламинов и др.), пуриновых и пиримидиновых азотистых оснований, амидов аминокислот в тканях организма. Часть аммиака образуется в кишечнике в результате деятельности микрофлоры (гниение белков) и всасывается в кровь воротной вены. Содержание аммиака в крови в норме 25-40 мкмоль/л.
Причины токсичности аммиака
1. Аммиак сдвигает реакцию, катализируемую глутаматдегидрогеназой, в сторону образования глутамата. В результате снижается концентрация a-кетоглутарата, что вызывает угнетение обмена аминокислот (переаминирования) и гипоэнергетическое состояние (угнетение цикла Кребса).
2. Аммиак усиливает синтез глутамина из глутамата в нервной ткани. Снижение концентрации глутамата нарушает обмен нейромедиаторов, в частности синтез g-аминомасляной кислоты – основного тормозного модулятора. Это нарушает проведение нервного импульса и вызывает судороги.
3. Аммиак в крови и цитозоле образует ион NH4+, накопление которого нарушает трансмембранный перенос ионов, в частности Na+ и К+, что также влияет на проведение нервного импульса.
4. Накопление аммиака может сдвигать рН в щелочную сторону, вызывая метаболический алкалоз.
Токсичный аммиак в клетках обезвреживается несколькими путями:
- используется на восстановительное аминирование (имеет небольшоезначение);
- используется на образование амидов (аспарагина и глутамина), которые поступают в кровь и переносятся в печень и почки, где под действием глутаминазы и аспарагиназы соответственно расщепляются до глутамата или аспартата и аммиака. В печени аммиак используется на образование карбамоилфосфата, из почек аммиак выводится в виде аммонийных солей с мочой.
- в мышцах аммиак используется на образование аланина, который выводится в кровь и переносится в печень, где после переаминирования превращается в пируват, используемый в ГНГ для синтеза глюкозы. Образовавшаяся глюкоза поступает в кровь и переносится в мышцы, где превращается в пируват в ходе гликолиза. Обмен метаболитами (аланином и глюкозой) между печенью и мышцей называется глюкозо-аланиновым циклом.
Синтез мочевины (орнитиновый цикл)
Синтез мочевины протекает в гепатоцитах печени, является процессом циклическим. Для синтеза одной молекулы мочевины требуется 3 молекулы АТФ, 1 молекула аммиака, 1 молекула аспартата, 1 молекула СО2, 1 молекула орнитина. Ход реакций смотрите в лекциях или в учебнике.
Орнитиновый цикл тесно связан с циклом Кребса:
а) цикл Кребса поставляет синтезу мочевины СО2 и АТФ.
б) фумарат, образованный в орнитиновом цикле, идет в цикл Кребса, превращаясь в оксалоацетат. Оксалоацетат путем переаминирования превращается в аспартат, который опять может использоваться в синтезе мочевины.
В результате орнитинового цикла очень токсичный аммиак превращается в безвредную мочевину - главный конечный продукт азотистого обмена млекопитающих. Мочевина из печени выделяется в кровь и переносится к почкам, где выделяется с мочой. Синтез мочевины усиливают катехоламины и глюкокортикостероиды.
Определение активности аргиназы и орнитинкарбамоилфосфаттрансферазы в сыворотке крови используется для диагностики патологий печени.
Обмен ароматических аминокислот
Йодтиронины
гидроксилаза


 фенилаланин тирозин ДОФА меланин
фенилаланин тирозин ДОФА меланин
 |  | ||||
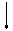 | |||||
фенилпируват гидроксифенил- катехоламины
 пируват
пируват
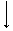 |
фениллактат гомогентизиновая
кислота
 |  | ||
фумарат ацетоацетат
Патологии обмена ароматических аминокислот
1. Фенилкетонурия или пировиноградная олигофрения (слабоумие). Причины: отсутствует ген, отвечающий за синтез фенилаланингидроксилазы. В отсутствие этого фермента фенилаланин переаминируется с образованием фенилпирувата и далее фениллактата. При этом не хватает тирозина, из которого образуются катехоламины и йодтиронины, а также пигмент меланин. У больных снижается устойчивость к стрессу, падает артериальное давление, появляются признаки умственной отсталости. В крови накапливаются фенилаланин, фениллактат и фенилпируват, которые в больших концентрациях являются токсичными, особенно для головного мозга ребенка, необратимо повреждая его. Поэтому требуется ранняя диагностика этого заболевания, которая проводится следующим образом: к моче ребенка добавляют хлорное железо; зеленое окрашивание свидетельствует о наличии патологии. В этом случае больного ребенка переводят на диету, обедненную фенилаланином, но богатую тирозином.
2. Алкаптонурия возникает при отсутствии гомогентизинатоксидазы. В этом случае нарушается окисление гомогентизиновой кислоты в тканях, повышается ее содержание в жидкостях организма и моче. В присутствии кислорода гомогентизиновая кислота полимеризуется с образованием алкаптона (пигмента черного цвета). Поэтому моча таких больных на воздухе темнеет. Алкаптон может откладываться в коже, сухожилиях, хрящах носа, ушей и суставов. При значительных отложениях пигмента в суставах нарушается их подвижность.
3. Альбинизм возникает при отсутствии тирозиназы, которая участвует в превращении ДОФА в ДОФА-хинон и далее в меланин. В результате у людей возникает слабая пигментация кожи, волос, красноватый цвет радужной оболочки глаз.
Синтез креатина
Креатин - это небелковое азотсодержащее соединение, в образовании которого участвуют печень и почки. Процесс начинается в почках, где из глицина и аргинина образуются гликоциамин (гуанидиноацетат) и орнитин. Орнитин используется в синтезе мочевины. Гликоциамин поступает в кровь и переносится в печень, где он метилируется при участии S-аденозилметионина, превращаясь в креатин, который поступает в мышцы. Когда мышца находится в состоянии покоя, креатин под действием креатинкиназы и при участии АТФ превращается в креатинфосфат - запасной макроэрг. При мышечном сокращении фосфат с креатинфосфата переносится под действием креатинкиназы на АДФ с образованием АТФ. Конечным продуктом обмена креатина является креатинин, одновременное определение которого в крови и моче проводят для расчета клиренса, показывающего очистительную способность почек. Определение активности креатинкиназы в сыворотке крови используют для диагностики инфаркта миокарда.
