Применение перманганатометрии в медицинской практике и фармации
Титрование раствором перманганата калия используют для определения множества веществ – восстановителей и окислителей (с предварительным восстановлением).
Перманганатометрия – один из лучших способов определения железа в разных объектах. После растворения образца железо оказывается в степени окисления +3, поэтому его предварительно переводят в Fe2+ хлоридом олова (II) или металлами. Таким же образом с предварительным восстановлением можно определять V, Mo, W, U, Ti, Sn, Sb, которые после растворения образцов получаются в высшей степени окисления.
5Н2О2 + 2МnО4- + 6Н+ → 5О2 + 2Мn2+ + 8Н2О,
5[Fe(CN)6]4- + МnО4- + 8Н+ → 5[Fe(CN)6]3- + Мn2+ + 4Н2О,
5АsIII + 2МnО4- + 16Н+ → 5Аsv + 2Мn2+ + 8Н2О.
Перманганатометрию используют для определения нитритов по реакции:
Прямое титрование невозможно: поскольку нитрит в кислой среде неустойчив, поэтому добавляют избыток перманганата и через некоторое время оттитровывают избыток стандартным раствором соли Мора.
Раствор перманганата можно использовать для определения ионов, образующие малорастворимые оксалаты (Сa, Mg, Zn, Ba, Pb, Ag, Sr, Co). Обратным перманганатометрическим титрованием определяют восстановители, реагирующие с KMnO4 медленно – иодиды, цианиды, фосфиты и др
Перманганатометрия используется для определения общей окисляемости воды или почвы. При этом с MnO4– – ионом в кислой среде реагируют все органические компоненты.
В биохимии и в клиническом анализе методом перманганатометрии определяют содержание мочевой кислоты в моче, ионы Ca2+ в кровяной сыворотке, сахара в крови.
Лабораторная работа.
«Перманганатометрическое титрование»
Цель работы Научиться проводить стандартизацию раствора перманганата калия. Уметь применять навыки перманганатометрического титрования для определения концентрации исследуемого раствора.
Реактивы и оборудование
Бюретки на 25 мл в штативе, химические воронки, пипетки Мора на 5мл и 10мл, колбы конические для титрования на 100мл,резиновые груши,стаканчики для слива;водяная баня, спиртовой термометр, стандартный раствор щавелевой кислоты H2C2O4 , 0,05N концентрации, раствор KMnO4, 2н раствора H2SO4, исследуемый раствор Н2О2.
Работа 1. Установление нормальности и титра KMnO4 по 0,05н раствору щавелевой кислоты
Нормальность и титр KMnO4устанавливают по щавелевой кислоте. В основе процесса титрования лежит реакция между KMnO4 и H2C2O4·H2O в кислой среде:
2KMnO4 + 5H2C2O4 + 3H2SO4 = 2MnSO4 + 10CO2 + K2SO4 + 8H2O
Ход определения
Бюретку заполняют раствором KMnO4. Кончик бюретки должен быть полностью заполнен раствором перманганата.
В коническую колбу для титрования с помощью пипетки вносят 5мл раствора щавелевой кислоты H2C2O4. Добавляют 2–2,5 мл 2н раствора H2SO4 и нагревают на водяной бане до 70o–80oC, не допуская кипения раствора. Горячий раствор титруют перманганатом калия, добавляя его по каплям и непрерывно перемешивая. Первые капли KMnO4 обесцвечиваются не сразу. Пока не произошло обесцвечивание, не рекомендуется приливать последующие капли. Титрование прекращают, когда прибавление очередной капли раствора KMnO4 вызывает уже неисчезающую розовую окраску содержимого колбы в течение 1–2 минут. Объем KMnO4, затраченный на титрование отмечают на бюретке по верхнему мениску.
Титрование повторяют 3 раза и данные записывают в таблицу 1.
Таблица 1
Результаты опыта
| № | V(H2C2O4 2H2O) | N(H2C2O4 2H2O) | V(KMnO4) | N(KMnO4) | T(KMnO4) |
| ср |
Нормальность и титр раствора перманганата калия вычисляют, исходя из среднего объема раствора KMnO4, затраченного на титрование
Работа 2. Определение перекиси водорода в растворе.
Перекись водорода в кислой среде окисляется перманганатом калия. В соответствии с уравнением реакции:
Задачи для самостоятельного решения.
Пример 1
Какая масса (г) пероксида водорода содержится в пробе, если при титровании израсходовано 14,50 мл перманганата калия с Т(КMnО4/Fe) = 0,08376 г/мл ?
Решение.
При прямом титровании число молей эквивалента определяемого вещества (пероксида водорода) равно числу молей эквивалента титранта (перманганата калия). При перманганатометрическом титровании пероксида водорода протекает реакция
5Н2О2 + 2МnО4- + 6Н+ → 5О2 + 2Мn2+ + 8Н2О
и соответствующие полуреакции:
МnО4- + 8Н+ + 5е → Мn2+ + 4Н2О
Н2О2 – 2e- →О2 + 2Н+
Из уравнений следует, что fэ(КMnО4) = 1/5, а fэ(Н2О2) = ½, поскольку один электрон химически эквивалентен условным частицам 1/5 КMnО4 и ½ Н2О2. Следовательно,
n(1/5КMnО4) = Т(KMnO4/Fe)∙V(KMnO4)/М(Fe)
и n(1/2 H2O2) =m(H2O2)/М(1/2 Н2О2)
Поскольку n(1/5 KMnO4) = n(1/2 H2O2), то после преобразований получаем
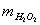 = Т(KMnO4/Fe)∙V(KMnO4)/М(Fe)∙М(1/2 Н2О2)
= Т(KMnO4/Fe)∙V(KMnO4)/М(Fe)∙М(1/2 Н2О2)
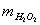 = (0,08376∙14,50/55,847)∙17,0073=0,3699 г.
= (0,08376∙14,50/55,847)∙17,0073=0,3699 г.
1. Рассчитайте навеску KMnO4, необходимую для приготовления 1 л 0,02н раствора.
2. На титрование 4,5 мл 0,1н раствора щавелевой кислоты израсходовано 55 мл KMnO4. Рассчитайте нормальность и титр раствора KMnO4.
3. Сколько граммов KMnO4 надо взять, чтобы приготовить 1,5л 0,05Н раствора его для титрования в кислой среде?
4. До какого объема следует разбавить 500мл 0,1Н раствор K2Cr2O7 для получения раствора с титром 0,005г/мл?
5. К раствору, содержащему 0,1510г технического Na2SO3 прилили 100мл 0,0985Н раствора I2, избыток которого оттитровали 48,6мл 0,0204Н раствора Na2S2O3. Вычислить процентное содержание Na2SO3 в образце?
