Энергия ионизации, сродства атомов к электрону и электроотрицательность. Что они характеризуют и как изменяются в периодах и группах?
Эне́ргией сродства́ а́тома к электро́ну, или просто его сродством к электрону (ε), называют энергию, выделяющуюся в процессе присоединения электрона к свободному атому Э в его основном состоянии с превращением его в отрицательный ион Э− (сродство атома к электрону численно равно, но противоположно по знаку энергии ионизации соответствующего изолированного однозарядного аниона).
Э + e− = Э− + ε
Сродство к электрону выражают в килоджоулях на моль (кДж/моль) или в электронвольтах на атом (эВ/атом).
В отличие от ионизационного потенциала атома, имеющего всегда эндоэнергетическое значение, сродство атома к электрону описывается как экзоэнергетическими, так и эндоэнергетическими значениями (см. табл.).
Зависимость сродства к электрону атома от атомного номера элемента (экзоэффект указан со знаком минус, эндоэффект со знаком плюс)
| Таблица 1 Энергия сродства некоторых атомов к электрону, эВ | |||||
| Элемент | ε | Элемент | ε | Элемент | ε |
| H | -0,75 | Na | -0,78 | K | -0,92 |
| He | 0,30 | Mg | 0,32 | Ca | 0,40 |
| Li | -0,58 | Al | -0,52 | Sc | 0,14 |
| Be | 0,19 | Si | -1,39 | Ti | -0,40 |
| B | -0,33 | P | -0,78 | V | -0,94 |
| C | -1,12 | S | -2,07 | Cr | -0,98 |
| N | 0,27 | Cl | -3,61 | Mn | 1,07 |
| О | -1,47 | Br | -3,36 | Fe | -0,58 |
| F | -3,45 | I | -3,06 | Co | -0,94 |
| Ne | 0,55 | Ni | -1,28 | ||
| Cu | -1,80 |
Наибольшим сродством к электрону обладают p-элементы VII группы. Наименьшее сродство к электрону у атомов с конфигурацией s2 (Be, Mg, Zn) и s2p6 (Ne, Ar) или с наполовину заполненными p-орбиталями (N, P, As):
| Таблица 2 | ||||||||
| Li | Be | B | C | N | O | F | Ne | |
| Электронная конфигурация | s1 | s2 | s2p1 | s2p2 | s2p3 | s2p4 | s2p5 | s2p6 |
| ε, эВ | -0,59 | 0,19 | -0,30 | -1,27 | 0,21 | -1,47 | -3,45 | 0,22 |
Небольшие расхождения в цифрах между табл. 1 и табл. 2 обусловлены тем, что данные взяты из разных источников, а также погрешностью измерений.
Электроотрицательность. Понятие электроотрицательности(ЭО) позволяет оценить способность атома данного элемента к оттягиванию на себя электронной плотности по сравнению сдругими элементами соединения. Очевидно, что эта способность зависит от энергии ионизации атома и его сродства к электрону. Согласно одному из определений (Малликен)электроотрицательность атома х может быть выражена как полусумма его энергии ионизации и сродства к электрону.
Электроотрицательность — это количественная характеристика способности атома в молекуле притягивать к себе электроны. Она равна полусумме энергии ионизации и сродства атома к электрону. Зависимость электроотрицательности отпорядкового номера элемента носит периодический характерэлектроотрицательность возрастает внутри периода и уменьшается внутри группы периодической системы элементов. На практике пользуются относительными значениямиэлектроотрицательности (ОЭО), принимая за единицу электроотрйцательность лития
Основные тенденции периодического изменения свойств элементов следующие. В группе элементов вертикальная периодичность) при возрастании порядкового номерапроисходит увеличение размеров атомов и уменьщениеихэнергии ионизации и сродства к электрону,электроотрицательности элементов и т. п. Вдоль периодаэлементов горизонтальная периодичность) при возрастаниипорядкового номера происходит периодическое увеличениеэнергии ионизации атомов и их сродства к электрону,электроотрицательности элементов с одновременным уменьщением размеров их атомов. Изменение эффективности атомного номера (эффективного заряда ядра 2 ), ровное вдоль периода, несмотря на разное число элементов в периодах.
Неметаллические элементы отличаются от металлическихэлементов более высокими значениями энергии ионизации, сродства к электрону и электроотрицательностей.
Электроотрицательность. Понятие злектроотрицательности (ЭО) позволяет оценить способность атома данного элемента к оттягиванию на себя электронной плотности по сравнению сдругими элементами соединения. Очевидно, что эта способность зависит от энергии ионизации атома и его сродства к электрону. Согласно одному из определений (Малликен)электроотрицателыюсть атома / может быть выражена как полусумма его энергии ионизации и сродства к электрону X 2 (/ + Р)- Имеется около 20 шкал электроотрнцатель-нссти, в основу расчета значений которых положены разные свойства в(ществ.Значенияэлектроотрицательностей разных шкал отли- [c.36]
В каждом периоде периодической таблицы наблюдаетсяобщая тенденция к возрастанию энергии ионизации с увеличением порядкового номера элемента. Сродство к электрону оказывается наибольшим у кислорода и галогенов. Атомы с устойчивыми орбитальными конфигурациями.(s , s p , s p ) имеют очень небольшое (часто отрицательное) сродство к электрону. Расстояние между ядрами двух связанных атомов называется длиной связи. Атомный радиус водорода Н равенполовине длины связи в молекуле Hj- В каждом периоде периодической таблицы наблюдается в общем закономерноеуменьшение атомного радиуса с ростом порядкового номера элемента.
БИЛЕТ 13
Периодический закон. В чем причина периодического изменения свойств элементов с увеличением заряда ядра? Короткопериодный вариант периодической системы элементов. Изменение свойств элементов в периодах и группах.
Периодические изменения свойств химических элементов обусловлены правильным повторением электронной конфигурации внешнего энергетического уровня (валентных электронов) их атомов с увеличением заряда ядра.
Графическим изображением периодического закона является периодическая таблица. Она содержит 7 периодов и 8 групп.
Период - горизонтальные ряды элементов с одинаковым максимальным значением главного квантового числа валентных электронов.
Номер периода обозначает число энергетических уровней в атоме элемента.
Периоды могут состоять из 2 (первый), 8 (второй и третий), 18 (четвертый и пятый) или 32 (шестой) элементов, в зависимости от количества электронов на внешнем энергетическом уровне. Последний, седьмой период незавершен.
Все периоды (кроме первого) начинаются щелочным металлом (s-элементом), а заканчиваются благородным газом (ns2 np6).
Металлические свойства рассматриваются, как способность атомов элементов легко отдавать электроны, а неметаллические - присоединять электроны из-за стремления атомов приобрести устойчивую конфигурацию с заполненными подуровнями. Заполнение внешнего s- подуровня указывает на металлические свойства атома, а формирование внешнего p- подуровня - на неметаллические свойства. Увеличение числа электронов на p- подуровне (от 1 до 5) усиливает неметаллические свойства атома. Атомы с полностью сформированной, энергетически устойчивой конфигурацией внешнего электронного слоя (ns2 np6) химически инертны.
В больших периодах переход свойств от активного металла к благородному газу происходит более плавно, чем в малых периодах, т.к. происходит формирование внутреннего (n - 1) d- подуровня при сохранении внешнего ns2 - слоя. Большие периоды состоят из четных и нечетных рядов.
У элементов четных рядов на внешнем слое ns2 - электроны, поэтому преобладают металлические свойства и их ослабление с ростом заряда ядра невелико; в нечетных рядах формируется np- подуровень, что объясняет значительное ослабление металлических свойств.
Группы - вертикальные столбцы элементов с одинаковым числом валентных электронов, равным номеру группы. Различают главные и побочные подгруппы.
Главные подгруппы состоят из элементов малых и больших периодов, валентные электроны которых расположены на внешних ns- и np- подуровнях.
Побочные подгруппы состоят из элементов только больших периодов. Их валентные электроны находятся на внешнем ns- подуровне и внутреннем (n - 1) d- подуровне (или (n - 2) f- подуровне).
В зависимости от того, какой подуровень (s-, p-, d- или f-) заполняется валентными электронами, элементы периодической системы подразделяются на: s- элементы (элементы главной подгруппы I и II групп), p- элементы (элементы главных подгрупп III - VII групп), d- элементы (элементы побочных подгрупп), f- элементы (лантаноиды, актиноиды).
В главных подгруппах сверху вниз металлические свойства усиливаются, а неметаллические ослабевают. Элементы главных и побочных групп сильно отличаются по свойствам.
Номер группы показывает высшую валентность элемента (кроме O, F, элементов подгруппы меди и восьмой группы).
Общими для элементов главных и побочных подгрупп являются формулы высших оксидов (и их гидратов). У высших оксидов и их гидратов элементов I - III групп (кроме бора) преобладают основные свойства, с IV по VIII - кислотные.
Для элементов главных подгрупп общими являются формулы водородных соединений. Элементы главных подгрупп I - III групп образуют твердые вещества - гидриды (водород в степени окисления - 1), а IV - VII групп - газообразные. Водородные соединения элементов главных подгрупп IV группы (ЭН4) - нейтральны, V группы (ЭН3) - основания, VI и VII групп (Н2Э и НЭ) - кислоты.
От положения элементов в периодической системе зависят свойства атома, связанные с его электронной конфигурацией: атомный радиус - по периоду слева направо уменьшается, а в подгруппе сверху вниз возрастает; энергия ионизации - по периоду возрастает, а в подгруппе уменьшается; электроотрицательность - по периоду увеличивается, а в подгруппе уменьшается.
В периодах отначалак периода к концу (слева направо) усиливаются кислотные (неметаллические) свойства и ослабевают основные (металлические) свойства в связи с увеличением количества электронов на внешнем электронном уровне. В группах от начала к концу (сверху вниз) усиливаются металлические (основные) свойства и ослабевают неметаллические (кислотные свойства) в связи с увеличением электронных уровней и меньшим притяжение электронов внешнего уровня к ядру
Короткая форма периодической системы элементов восходит к первоначальной версии таблицы Менделеева:[1] Короткая форма таблицы Менделеева основана на параллелизме степеней окисления элементов главных и побочных подгрупп: например, максимальная степень окисления ванадия равна +5, как у фосфора и мышьяка, максимальная степень окисления хрома равна +6, как у серы и селена, и т. д. В таком виде таблица была опубликована Менделеевым в 1878 году (до этого группы группировались в ряды, а не в колонки)
Изменение свойств элементов
По периоду слева направо:
заряд ядра атома - увеличивается;
радиус атома - уменьшается;
количество электронов на внешнем уровне - увеличивается;
электроотрицательность - увеличивается;
отдача электронов - уменьшается;
прием электронов - увеличивается.
По группе сверху вниз:
заряд ядра атома - увеличивается;
радиус атома - увеличивается;
количество электронов на внешнем уровне - не изменяется;
электроотрицательность - уменьшается;
отдача электронов - увеличивается;
прием электронов - уменьшается.
Причина изменения свойств также объясняется строением атомов химических элементов.
Каждый период начинается элементом щелочным металлом (исключение – первый период), в атомах которых на внешнем энергетическом уровне имеются один s – электрон. Общая электронная формула строения внешнего энергетического уровня щелочных металлов ns1 , где n – номер периода.
Каждый период заканчивается элементом благородным газом. В атомах элементов благородных газов на внешнем энергетическом уровне имеются два s- и шесть p-электронов. Общая электронная формула строения внешнего энергетического уровня благородных газов ns2np6 , где n - номер периода (исключение: гелий He - ns2).
Период - это горизонтальная последовательность элементов по возрастанию порядкового (атомного) номера элемента, атомы которых имеют одинаковое число энергетических уровней, численно равное номеру периода.
В периодах металлические свойства уменьшаются, а неметаллические свойства увеличиваются.
В больших периодах изменения свойств происходят медленнее, что объясняется появлением десяти d-элементов (4-й, 5-й периоды) и четырнадцати f-элементов (6-й, 7-й периоды).
По группам (в главных подгруппах) металлические свойства увеличиваются, а неметаллические уменьшаются.
Группа - это вертикальная последовательность элементов по возрастанию порядкового (атомного) номера, обладающая схожими свойствами.
Главная подгруппа - это вертикальная последовательность s- и p-элементов с одинаковым числом электронов на внешнем энергетическом уровне, равным номеру группы.
Побочная подгруппа - это вертикальная последовательность d- и f-элементов, которые имеют одинаковое суммарное количество валентных электронов.
Следовательно, возможна третья формулировка Периодического закона, которая отражает причину периодического изменения свойств.
Свойства химических элементов и образованных ими соединений находятся в периодической зависимости от строения внешних энергетических уровней атомов.
Билет №14
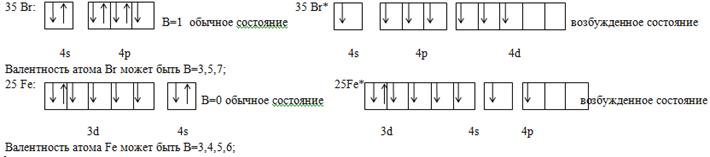
Ковалентная химическая связь. Ее характерные особенности: насыщаемость, полярность и направленность. Определение элементов по методу валентных связей. Рассмотреть на примере 26 и 35 элементов.
Ковалентная связь – химическая связь между атомами, осуществляемая обобществленными электронами. Ковалентная связь является универсальным типом химической связи. Ковалентная связь существует между атомами как в молекулах, так и в кристаллах. Она возникает как между одинаковыми атомами ( например, в молекулах 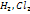 , в кристалле алмаза), так и между разными атомами (например, в молекулах
, в кристалле алмаза), так и между разными атомами (например, в молекулах 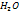 и
и 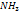 , в кристаллах SiC). Почти все связи в молекулах органических соединений являются ковалентными. (С-С, С-Н, С-N и др.).
, в кристаллах SiC). Почти все связи в молекулах органических соединений являются ковалентными. (С-С, С-Н, С-N и др.).
Характерными особенностями ковалентной связи является ее насыщаемость и направленность.
Насыщаемость ковалентных связей обусловлена тем, что при химическом взаимодействии участвуют электроны только внешних энергетических уровней, т.е. ограниченное число электронов.
Направленность связи обусловлена молекулярным строением вещества и геометрической формы их молекулы. Углы между двумя связями называют валентными.
Полярность связи обусловлена неравномерным распределением электронной плотности вследствие различий в электроотрицательностях атомов.
Химическая связь, образованная путем обобществления пары электронов двумя атомами, называется ковалентной. Объяснение химической связи возникновением общих электронных пар между атомами легло в основу спиновой теории валентности, инструментом которой является метод валентных связей (МВС), открытый Льюисом в 1916 г.
Основные принципы образования химической связи по МВС:
1. Химическая связь образуется за счет валентных (неспаренных) электронов.
2. Электроны с антипараллельными спинами, принадлежащие двум различным атомам, становятся общими.
3. Химическая связь образуется только в том случае, если при сближении двух и более атомов полная энергия системы понижается.
4. Основные силы, действующие в молекуле, имеют электрическое, кулоновское происхождение.
5. Связь тем прочнее, чем в большей степени перекрываются взаимодействующие электронные облака.
Существует два механизма образования ковалентной связи
Обменный механизм. Связь образована путем обобществления валентных электронов двух нейтральных атомов. Каждый атом дает по одному неспаренному электрону в общую электронную пару:
а) б)
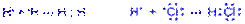
Рис. Обменный механизм образования ковалентной связи: а – неполярной; б – полярной
Донорно-акцепторный механизм. Один атом (донор) предоставляет электронную пару, а другой атом (акцептор) предоставляет для этой пары свободную орбиталь. Соединения, образованные по донорно-акцепторному механизму, относятся к комплексным соединениям
Согласно МВС валентность электронов определяется числом неспаренных электронов, находящихся в атоме, причем для s и p элементов это электроны, находящиеся на внешнем и предвнешнем электронных слоях.
Билет №15
Полярность связи. Дипольный момент и единицы его измерения. Отличаются ли полярность связи и молекул? Приведите примеры.
Полярность химических связей — характеристика химической связи (как правило ковалентной), показывающая изменение распределения электронной плотности в пространстве вокруг ядер в сравнении с распределением электронной плотности в образующих данную связь нейтральных атомах.
Если молекула образована одинаковыми атомами (O2, H2, Cl2), то между ними образуется неполярная ковалентная связь. В таком случае валентные электроны притягиваются атомами с равной силой, поэтому общее электронное облако расположено симметрично относительно обоих атомов. Электронная пара, образующая связь, в равной степени принадлежит обоим атомам.
Если ковалентную связь в молекуле образуют атомы разных элементов, то она будет полярной. В полярной ковалентной связи электронная пара смещена к атому с большей электроотрицательностью, то есть к тому, который сильнее притягивает электроны.
Количественной характеристикой полярности связи является дипольный момент.
µ=e*l, где [µ]=Кл*м, e- заряд, l – расстояние между зарядами
1D (Дебай) =3*10^-33 Кл*м
Следует различать полярность связи и полярность молекулы. В случае двухатомных молекул очевидно, что наличие полярной связи означает наличие диполя. В случае же многоатомных молекул в возникновении диполя играет роль и пространственное строение молекул. Так, молекула оксида углерода (II) линейна:
О = С = О
Обе связи С = О полярны, причем дипольный момент каждой отдельной связи весьма значителен (mС=0 = 2,7 Д). Однако, вследствие симметричности молекулы, взаимная компенсация зарядов приводит к тому, что вся молекула оказывается неполярной: mС=0 = 0. Если же молекула нелинейна (например, Н2О, угол Н – О – Н около 1050), то дипольные моменты связей не компенсируются, и вся молекула представляет диполь (mС=0 = 1,84 Д).
Билет №16
Атом бора имеет один неспаренный электрон, но способен образовывать соединение BH3. Почему? Какой тип гибридизации реализуется в этом соединение , и какое строение оно имеет?
Атом Бора имеет способность распаривать электроны находящиеся на внешнем уровне – проявлять возбужденное состояние (электрон с 2S подуровня переходит на 2P подуровень)
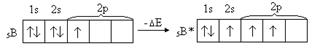
Атом бора в основном состоянии одновалентен. Атом бора в возбужденном состоянии имеет три неспаренных электрона и может образовывать соединения, где он будет трёхвалентен. Энергия, затраченная на переход атома в возбуждённое состояние в пределах одного энергетического уровня, как правило, с избытком компенсируется энергией, выделяющейся при образовании дополнительных связей.
В этом соединение реализуется SP2 гибридизация.
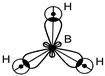
sp2–гибридизация АО В, 3 s - связи, Ð 120° , связи полярные. Структура молекулы - плоский треугольник. Молекула ВН3 – неполярная.
Билет № 17
