Расчет концентрации растворов
ОБЩАЯ И БИООРГАНИЧЕСКАЯ ХИМИЯ
Учебное пособие
Рекомендовано Учебно-методическим объединением по медицинскому и фармацевтическому образованию вузов России в качестве учебного пособия для студентов, обучающихся по специальностям:
060101 Лечебное дело, 060103 Педиатрия,
060105 Медико-профилактическое дело, 060201 Стоматология.
ВОРОНЕЖ – 2013
УДК 547 (081)
ББК 24.1+28.072
У 912
Общая и биоорганическая химия. Учеб. пособие / Н.И. Пономарева [и др.]. – Воронеж : Изд-во ВГМА, 2013. – 199 с.
Составители:
Зав. кафедрой химии, д.х.н., профессор Н.И.Пономарева, к.х.н., доцент Е.И.Рябинина, к.х.н., ст. препод. Е.Е.Зотова, к.б.н., доцент В.М.Клокова, ассистент Н.М.Овечкина, ассистент Т.Д.Попрыгина
Под редакцией профессора Н.И. Пономаревой
Настоящее учебное пособие написано в соответствии с ФГОС Высшего профессионального образования по дисциплине «Химия», специальностям: 060101 «Лечебное дело», 060103 «Педиатрия», 060201 «Стоматология» и дисциплине «Общая и биоорганическая химия», специальности 060105 «Медико-профилактическое дело». Каждый раздел содержит теоретическое введение, детальное решение типовых задач, а также задания для самостоятельной работы студентов по основным разделам общей и биоорганической химий. Важная цель сборника – показать, как глубоко связана химия с медициной и повседневной жизнью. Необходимые для полноценного усвоения химии типовые и комплексные задачи и тесты по своему содержанию имеют профессиональную медицинскую направленность, т.е. обеспечивают профессионализацию данного курса в медицинском вузе.
Рецензенты:
Зав. кафедры общей и биоорганической химии ГБОУ ВПО «Курский государственный медицинский университет» Министерства здравоохранения и социального развития Российской Федерации, доктор фармацевтических наук, профессор Будко Е.В.
Зав. кафедры общей и биоорганической химии ГБОУ ВПО «Саратовский государственный медицинский университет им. В.И.Разумовского» Министерства здравоохранения Российской Федерации, доктор химических наук, профессор Решетов П.В.
Печатается по решению Центрального методического совета ВГМА им. Н.Н. Бурденко от 31.05.2012 (протокол № 6).
Решение УМО по медицинскому и фармацевтическому образованию вузов России № 380/05.05-20 от 19.09.2012 года.
© ВГМА, 2013
«Медик без довольного познания химии совершен быть не может, от одной только химии уповать должно на исправление недостатков врачебной науки»
М.В. Ломоносов
«Врачу химия нужна не только для того, чтобы приготавливать лекарства, но и для того, чтобы исследовать причины болезней и действие медикаментов»
Теофраст Парацельс
| СОДЕРЖАНИЕ | стр |
| Расчет концентрации растворов | |
| Показатели рН и рОН. Гидролиз солей. Метод нейтрализации | |
| Окислительно-восстановительные реакции. Оксидиметрия | |
| Химическая термодинамика | |
| Химическая кинетика. Химическое равновесие | |
| Комплексные соединения. Комплексонометрия | |
| Теория растворов сильных электролитов | |
| Гетерогенные реакции в растворах электролитов | |
| Коллигативные свойства растворов | |
| Буферные системы. Кислотно-основное состояние | |
| Строение атома. Периодическая система. Химическая связь | |
| Биогенные элементы | |
| Электрохимия | |
| Электропроводность растворов электролитов | |
| Равновесные электродные процессы. Электрохимические цепи | |
| Поверхностные явления. Адсорбция | |
| Гидрофобные золи | |
| Свойства растворов высокомолекулярных соединений | |
| Основные принципы классификации и номенклатуры органических соединений. Пространственное строение органических молекул. Электронное строение химических связей атомов углерода и взаимное влияние атомов в органических молекулах. Сопряженные системы | |
| Спирты и фенолы | |
| Амины | |
| Альдегиды и кетоны | |
| Углеводы | |
| Карбоновые кислоты и их функциональные производные | |
| Липиды | |
| Аминокислоты. Белки | |
| Гетероциклы | |
| Нуклеиновые кислоты | |
| Рекомендуемая литература | |
| Ответы |
РАСЧЕТ КОНЦЕНТРАЦИИ РАСТВОРОВ
Растворы – гомогенные (однородные) системы переменного состава, содержащие два или несколько компонентов. Компонент, агрегатное состояние которого не изменяется при образовании раствора, принято называть растворителем, а другой компонент – растворенным веществом. При одинаковом агрегатном состоянии компонентов растворителем считают обычно то вещество, которое преобладает в растворе. Растворы бывают твердыми (сплавы металлов), жидкими и газообразными (смеси газов). В медицине наиболее распространены жидкие (чаще водные) растворы.
Концентрация раствора – величина, измеряемая количеством растворенного вещества в определенном объеме или массе раствора или растворителя. Существуют различные способы выражения концентрации растворов:
Процентная концентрация по массе С% (массовая доля)показывает число единиц массы растворенного вещества (г, кг) в 100 единицах массы раствора (г, кг) и рассчитывается по формуле:
С%=mв-ва· 100% / mр-ра (1),
где mр-ра - масса раствора, в котором содержится масса вещества mв-ва . Следовательно, физиологический раствор (0,9% NaCl) содержит 0,9г NaCl в 100г раствора.
Молярная концентрация СМ (молярность) показывает число молей растворенного вещества в 1л (1дм3) раствора. Согласно определению СМ= ν/V, где количество вещества ν=m/M, а объем раствора V выражен в литрах. Таким образом получаем формулу:
СМ=m / М·V (2),
где m-масса вещества, г; М-молярная масса вещества, г/моль; V – объем раствора, л.
Например, 5М раствор глюкозы содержит 5моль С6Н12О6 в 1л раствора.
Нормальная концентрация СN (нормальность, молярная концентрация эквивалента) показывает, сколько эквивалентов вещества находится в 1л (1дм3) раствора. Эквивалент Э (эквивалентная масса, молярная масса эквивалента) –это реальная или условная частица вещества, которая в данной реакции реагирует с одним атомом или ионом водорода, или одним электроном. Эквивалент зависит от типа реакции, в которой участвует данное вещество. В рамках нашего курса не рассматривается образование кислых, основных солей, а также более сложных продуктов, поэтому эквивалент кислоты находится делением молярной массы кислоты на ее основность (число атомов водорода в формуле), эквивалент основания – делением молярной массы на кислотность (число ОН групп), эквивалент соли равен молярной массе, деленной на произведение степени окисления металла на число его атомов в формуле. Например, Э(Н2SO4)= 98/2=49 (г/моль), Э(Са(ОН)2)=74/2=37 (г/моль), Э(Al2(SO4)3)=342/3·2=57 (г/моль). Для реагентов, используемых в окислительно-восстановительных реакциях, эквивалент находят делением молярной массы на число участвующих в превращении электронов.
Нормальную концентрацию рассчитывают по формуле:
СN=m /Э ·V (3),
где m-масса вещества, г; Э-эквивалент, г/моль; V – объем раствора, л. Запись 0,1N HCl (или 0,1н. HCl) означает, что 1л раствора содержит 0,1 эквивалента HCl.
Зная нормальность раствора, можно найти молярность, и наоборот. Так как масса растворенного вещества m=СN · Э · V= СM · M · V, то после сокращения объема получаем:
СN · Э = СM · M (4).
Моляльная концентрация Сm (моляльность) показывает число молей растворенного вещества в 1 кг (1000г) растворителя.
Сm = νв-ва / mр-ля = mв-ва / М · mр-ля (5),
где νв-ва - число моль вещества; mв-ва - масса вещества, г; mр-ля - масса растворителя, кг; М- молярная масса вещества, г/моль.
Например, 0.3Сm раствор NaOH содержит 0,3моль вещества на 1000г воды.
Титр Т - это масса вещества (г) в 1мл (1см3) раствора. Согласно определению Т=m/V (6),
где m –навеска вещества, г; V – объем раствора, мл.
Титр также может быть найден по формуле:
Т=Э · СN /1000 (7),
где Э-эквивалент вещества, г/моль; СN – нормальная концентрация, N; 1000 -коэффициент для пересчета размерности (в 1л 1000мл).
Мольная доля компонента – это отношение числа молей данного вещества к общему числу молей всех веществ в растворе. Если раствор содержит два компонента (1-растворенное вещество, 2- растворитель), то мольные доли находятся следующим образом:
Х1=ν1/( ν1+ ν2);
Х2=ν2/( ν1+ ν2) (8),
где ν1 – число моль растворенного вещества, ν2– число моль растворителя. В сумме Х1+ Х2=1.
Процентная концентрация считается приблизительной, остальные рассмотренные концентрации являются точными и широко применяются в медико-биологических исследованиях, химическом и фармакопейном анализе.
Примеры решения задач
Пример 1.
10мл сыворотки крови взрослого человека содержат 0.015 г холестерина (C27H47O). Найдите процентную концентрацию по массе (массовую долю) и молярность, если принять плотность сыворотки ρ ≈1 г/мл.
Решение:
Процентную концентрацию C% можно найти следующим образом:
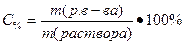 , где m(раствора) = V(раствора) · ρ =10 мл · 1г/мл = 10г, тогда C% =0.015·100/10=0.15%;
, где m(раствора) = V(раствора) · ρ =10 мл · 1г/мл = 10г, тогда C% =0.015·100/10=0.15%;
или воспользуемся определением процентной концентрации, которая показывает число грамм вещества в 100г раствора:
если 0.015г (холестерина) - в 10 г (сыворотки)
то X г (холестерина) - в 100 г (сыворотки),
и получаем такой же ответ: X=C% = 0.015 · 100 / 10 = 0.15 г = 0.15%
Молярная концентрация показывает число моль холестерина в 1 л раствора (сыворотки). Найдем сначала молярную(=молекулярную)массу: Mr(холестерина)= 27·Ar(C)+47·Ar(H)+1·Ar(O)=27·12+47·1+1·16=387;
М=387 г/моль , затем вычислим число моль вещества в данной пробе раствора (в 10мл): n = 0.015 / 387 = 0.0000388 (моль), наконец находим число моль вещества в 1л раствора: CM = 0.0000388 моль / 0.01 л = 0.00388 моль/л = 3.88 мМ.
Ответ: 0.15%; 3.88 мМ.
Пример 2.
Как приготовить 400мл 25% раствора магнезии (MgSO4) с плотностью ρ =1.2 г/мл из более концентрированного 5 М раствора?
Решение:
Найдем массу раствора, который мы собираемся приготовить:
m=V·ρ=400 ·1.2=480 (г)
В соответствии с определением процентной концентрации этот раствор должен содержать
25г (MgSO4) в 100г(раствора),
или X г (MgSO4) в 480г(раствора),
таким образом находим X=25·480 / 100 = 120 (г). Однако по условию задачи у нас нет кристаллического MgSO4 , который мы могли бы взвесить для приготовления раствора: нужно разбавить более концентрированный раствор, который содержит 5 моль (MgSO4) в 1л, или это m (MgSO4)= n· M=5моль · 120 г/моль = 600 г.
Следовательно, найдем объем 5M раствора, который содержит 120 г MgSO4 :
600г(MgSO4) – в 1000 мл
120г(MgSO4) – в X мл , тогда X= 200 мл.
Таким образом, мы отбираем 200мл 5M раствора MgSO4, помещаем в мерную колбу на 400мл, добавляем необходимое количество дистиллированной воды до метки (фактически раствор должен быть разбавлен в 2 раза).
Существует множество других способов решения этого задания. Например, можно использовать формулы или найти сначала число моль MgSO4, необходимое для приготовления раствора: n=120/120=1 моль, ...и т.д.].
Ответ: 200мл 5М р-ра разбавить до 400мл.
Пример 3.
Раствор MgSO4 , приготовленный в предыдущем задании, был проверен фармацевтом. Обнаружено, что точная концентрация раствора равна 2.5M. Найдите нормальность, титр, моляльность и мольную долю вещества, если плотность раствора равна 1.2 г / мл.
Каков курс лечения данным препаратом (сколько дней), если пациенту назначили инъекции по 5мл один раз в день и суммарная (кумулятивная) доза должна составить 125 ммоль?
Решение:
Для нахождения нормальной концентрации CN можно воспользоваться формулой CN ·Э = CM ·M, которая позволяет быстро перейти от молярности к нормальности (и наоборот). Для соли эквивалент равен: Э= 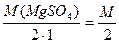 ,
,
поэтому CN ·M / 2 = CM ·M, после сокращения получаем CN = 2· CM = 2· 2.5 = 5 (N, н., моль/л)
Титр может быть найден следующим образом :
T=Э · CN / 1000 = 60 ·5 / 1000 = 0.3000 (г/мл)
Моляльная концентрация µ показывает число мольMgSO4 в 1 кг растворителя, поэтому найдем сначала массу 1л раствора, затем массу MgSO4, и наконец массу воды:
m(раствора) = ρ ·V = 1.2 ·1000 = 1200 (г),
m(MgSO4) = n · M = 2.5 · 120 = 300 (г),
m(H2O) = m(раствора) – m (MgSO4) = 1200-300 = 900 (г)
Если 2.5 моль (MgSO4) – в 900 г (воды),
то µ моль(MgSO4) – в 1000 г(воды), получаем µ=2.5·1000/900 = 2.78 (моль/кг)
Для нахождения мольной доли X найдем число моль воды:
n (H2O) = m / M = 900 / 18 = 50 (моль),
затем найдем отношение X(MgSO4) = 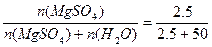 =0.048
=0.048
Если раствор магнезии используется в качестве лекарственного препарата, то с разовой дозой 5мл пациент получает следующее число моль MgSO4 :
2.5моль(MgSO4) – в 1000 мл(раствора)
X моль(MgSO4) - в 5 мл(раствора), тогда X=0.0125моль=12.5ммоль
ммоль(в день) · число дней = ммоль(суммарная доза)
12.5 · число дней = 125, => число дней = 10
Курс лечения 10 дней.
Ответ: 5н., 0.3000 г/мл, 2.78 моль/кг, 0.048; 10дней.
