Коррозия и защита металлов
При изучении этого раздела повторите теоретический материал по теме «Гальванические элементы» и проработайте следующие вопросы: определение и классификация коррозионных процессов; химическая коррозия; электрохимическая коррозия; защита металлов от коррозии [1, 10].
Пример 1. Показать какие из ниже перечисленных металлов: а) Zn; б) Fe; в) Hg; г) Cd; д) Ag – способны подвергаться коррозии в соляной кислоте.
Решение. Коррозия должна протекать по электрохимическому механизму, т.к. соляная кислота проводит электрический ток. Данная кислота за счет ионов Н+ выступает в роли окислителя. Определяем возможность коррозии, сравнивая электродные потенциалы всех перечисленных выше металлов (из табл. 9) с электродным потенциалом окислителя. При рН = 0 (кислая среда) и давлении водорода равном 1 атм  = 0 (см. табл. 10).
= 0 (см. табл. 10).
Следовательно, коррозии будут подвергаться все металлы, у которых 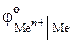 < 0. Это Zn, Fe и Cd. Устойчивы к кислотной коррозии будут Hg и Ag.
< 0. Это Zn, Fe и Cd. Устойчивы к кислотной коррозии будут Hg и Ag.
В качестве примера рассмотрим, какие процессы будут протекать при коррозии цинка в соляной кислоте.
Процесс окисления (на анодных участках):
А: Zn – 2 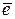 = Zn2+.
= Zn2+.
Процесс восстановления (на катодных участках):
К: 2Н+ + 2 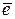 = Н2.
= Н2.
Анодные и катодные участки располагаются на поверхности цинка. Скорость анодного процесса связана со скоростью катодного. Так как скорость катодного процесса мала, о чем говорит большая величина перенапряжения выделения водорода на цинке (  = 0,83 В), то чистый цинк растворяется в кислоте медленно.
= 0,83 В), то чистый цинк растворяется в кислоте медленно.
Пример 2. В чем сущность протекторной защиты металлов от коррозии? Какие из металлов Zn, Cr, Sn, Cu можно использовать в качестве протектора при защите от коррозии детали из железа во влажной атмосфере?
Решение. Сущность протекторной защиты металлов от коррозии заключается в том, что защищаемый металл соединяют с другим металлом, имеющим более отрицательный электродный потенциал. В этом случае более активный металл является анодом и подвергается окислению, а защищаемый металл является катодом и не окисляется.
Из табл. 9 приложения находим значения 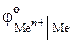 :
:
 = – 0,76 В;
= – 0,76 В;  = – 0,74 В;
= – 0,74 В; 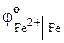 = – 0,44 В;
= – 0,44 В;
 = – 0,14 В;
= – 0,14 В;  = + 0,34 В.
= + 0,34 В.
Следовательно, цинк и хром можно использовать для протекторной защиты изделия из железа:
 <
<  <
< 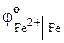 <
<  <
<  .
.
Пример 3. Какие металлы можно использовать в качестве анодного и катодного покрытий для изделия из меди? Какое покрытие называется анодным, а какое – катодным?
Решение. Покрытие называется анодным, если величина электродного потенциала металла более отрицательна по отношению к потенциалу защищаемого металла. Металл, применяемый в качестве катодного покрытия, имеет более положительную величину электродного потенциала по отношению к потенциалу защищаемого металла.
Анодные покрытия для меди: Al, Zn, Cr, Cd.
Катодные покрытия для меди: Ag, Pd, Pt.
Пример 4. Показать какие процессы протекают при коррозии цинка в контакте с железом в соляной кислоте. Условия те же, что и в примере 1.
Решение. На поверхности раздела металл-раствор имеются участки металлического цинка и металлического железа. Определим, какой металл легче окисляется. С термодинамической точки зрения цинк легче окисляется, чем железо, что показывает сравнение их электродных потенциалов:
 = – 0,44 В,
= – 0,44 В,  = – 0,76 В (табл. 9).
= – 0,76 В (табл. 9).
Поэтому процесс окисления (анодный процесс) локализуется на поверхности цинка:
А: Zn – 2 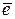 = Zn2+,
= Zn2+,
что приводит к его разрушению.
Наиболее сильный окислитель – ион Н + из раствора. Сравнивая электродные потенциалы окислителя и восстановителя  = 0 В ˃
= 0 В ˃  = – 0,76 В, т.е. что процесс коррозии возможен. Процесс восстановления (катодный процесс):
= – 0,76 В, т.е. что процесс коррозии возможен. Процесс восстановления (катодный процесс):
К: 2Н+ + 2 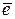 = Н2.
= Н2.
Определим, где располагаются катодные участки. Процесс выделения водорода локализуется там, где он протекает с наибольшей скоростью, то есть где наименьшее перенапряжение водорода. Сравним  на железе и на цинке:
на железе и на цинке:  = 0,36 В,
= 0,36 В,  = 0,83 В (см. табл. 11 приложения). Следовательно, катодный процесс локализуется на железе. Скорость катодного процесса на железе больше, чем на цинке, поэтому общая скорость коррозии цинка, содержащего примеси железа, намного больше, чем чистого цинка.
= 0,83 В (см. табл. 11 приложения). Следовательно, катодный процесс локализуется на железе. Скорость катодного процесса на железе больше, чем на цинке, поэтому общая скорость коррозии цинка, содержащего примеси железа, намного больше, чем чистого цинка.
Пример 5. Стальное изделие (основа железо) покрыто оловом. Какой из металлов будет подвергаться коррозии: а) в кислой среде на воздухе; б) во влажном воздухе при нарушении покрытия? Составьте схемы коррозионных гальванических элементов и напишите электронные уравнения электродных процессов.
Решение. Из табл. 9 находим стандартные электродные потенциалы:
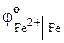 = – 0,44 В ˃
= – 0,44 В ˃  = – 0, 14 В. Следовательно, при нарушении покрытия как в кислой среде, так и во влажном воздухе, будет корродировать железо. Проверим это соответствующим расчетом.
= – 0, 14 В. Следовательно, при нарушении покрытия как в кислой среде, так и во влажном воздухе, будет корродировать железо. Проверим это соответствующим расчетом.
а) кислая среда
Электродные потенциалы анодного и катодного процесса оценим, исходя из условия задачи, активность ионов металлов в растворах электролитов примем аМеn+ < 10-6 моль/л, а перенапряжение выделения водорода на данных электродах в кислой среде соответственно равны  = 0,36 В и
= 0,36 В и  = 0,63 В (табл. 11 приложения).
= 0,63 В (табл. 11 приложения).

На Ме:  =
=  –
–  = 0,186 –
= 0,186 – 
В кислой среде на воздухе  = 0,186 В, так как парциальное давление водорода в воздухе не 1 атм, а равно
= 0,186 В, так как парциальное давление водорода в воздухе не 1 атм, а равно  = 5 ×10–7 атм.
= 5 ×10–7 атм.
На железе:  = 0,186 – 0,36 = – 0,174 В;
= 0,186 – 0,36 = – 0,174 В;
На олове:  = 0,186 – 0,63 = – 0,444 В.
= 0,186 – 0,63 = – 0,444 В.
Термодинамически более вероятна локализация катодного процесса на поверхности Fe, т.к.  <
<  . Значит, в растворе кислоты существует коррозионный гальванический элемент: (–) Fe | H+ | (Sn – Fe) (+).
. Значит, в растворе кислоты существует коррозионный гальванический элемент: (–) Fe | H+ | (Sn – Fe) (+).
Электронные уравнения электродных процессов:
А (Fe): Fe – 2 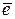 = Fe 2+
= Fe 2+
К (Fe): 2Н+ + 2 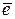 = Н2 (катодная деполяризация)
= Н2 (катодная деполяризация)
б) влажный воздух (атмосферная коррозия)
Катодный процесс описывается уравнением: О2 + Н2О + 4 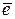 = 4ОН– (кислородная деполяризация). В предложенных условиях процесс с кислородной деполяризацией будет локализован на Sn. В этом случае возникнет гальванический элемент: (–) Fe | О2, Н2О | Sn (+).
= 4ОН– (кислородная деполяризация). В предложенных условиях процесс с кислородной деполяризацией будет локализован на Sn. В этом случае возникнет гальванический элемент: (–) Fe | О2, Н2О | Sn (+).
Электронные уравнения электродных процессов:
А (Fe): Fe – 2 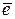 = Fe 2+
= Fe 2+
К (Sn): О2 + Н2О + 4 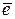 = 4ОН–.
= 4ОН–.
КОНТРОЛЬНЫЕ ЗАДАНИЯ
221. Стальное изделие (основа – железо) покрыто цинком. Какой из металлов будет окисляться при коррозии в кислой среде и влажном воздухе при нарушении покрытия? Напишите электронные уравнения на аноде и катоде.
222. Изделия из луженого и оцинкованного железа эксплуатируются в атмосфере влажного воздуха. Составьте схемы коррозионных микрогальванических элементов и напишите электронные уравнения электродных процессов при нарушении покрытий.
223. Алюминиевая пластинка опущена в разбавленный раствор серной кислоты. Начавшееся выделение водорода быстро прекращается. Если к алюминиевой пластинке в растворе кислоты прикоснуться серебряной пластинкой, то на последней начнется бурное выделение водорода. Поясните этот процесс, составьте электронные уравнения реакций, протекающих на аноде и катоде.
224. Какие металлы: Fe, Ag, Pd, At можно использовать в качестве протектора при защите от коррозии детали из меди (Cu) эксплуатируемой в морской воде? В чем сущность протекторной защиты металлов от коррозии?
225. Напишите уравнения катодного процесса, протекающего при коррозии изделия из бронзы (Cu + Sn + Pb) во влажном воздухе. Составьте схему коррозионного гальванического элемента.
226. Укажите ряд металлов, которые можно использовать в качестве катодного и анодного покрытий для изделия из железа. Какое покрытие называется анодным, а какое – катодным?
227. В раствор хлороводородной (соляной) кислоты опустили железную пластинку, частично покрытую никелем. В каком случае процесс коррозии железа протекает интенсивнее? Составьте схемы коррозионных гальванических элементов и напишите электронные уравнения электродных процессов.
228. Две железные пластинки, частично покрытые одна цинком, другая серебром, находятся во влажном воздухе. На какой из этих пластинок быстрее образуется ржавчина? Почему? Напишите электронные уравнения анодного и катодного процессов коррозии пластинок. Укажите продукты коррозии.
229. Напишите электронные уравнения процесса коррозии луженого железа (Fe – Sn) в нейтральной водной среде при свободном доступе воздуха. Целостность покрытия нарушена.
230. Стальное изделие (основа – железо) покрыли оловом. Какое это покрытие – анодное или катодное? Напишите электронные уравнения электродных процессов коррозии при нарушении покрытия во влажном воздухе и кислой среде (соляная кислота). Укажите продукты коррозии.
231. Как протекает атмосферная коррозия стального изделия (основа – железо), покрытого слоем кадмия в случае нарушения покрытия? Напишите электронные уравнения электродных процессов. Укажите продукты коррозии.
232. Лопатки паровых турбин изготовлены из конструкционной стали (основа – железо), содержащей марганец, олово, медь, эксплуатируются во влажной атмосфере. Используя значения стандартных электродных потенциалов, определите, какая составляющая стали будет корродировать в первую очередь. Напишите электронные уравнения электродных процессов.
233. Резьбовое крепежное изделие из инструментальной стали (основа – железо), содержащей кобальт и медь, покрыто цинком. Напишите электронные уравнения анодного и катодного процессов коррозии во влажном воздухе. К какому типу (анодному или катодному) относительно основного металла относится это покрытие?
234. Изделие из сплава железа с хромом, легированного марганцем, эксплуатируется в кислой среде. Какая составляющая сплава будет корродировать в первую очередь? Напишите электронные уравнения процессов на аноде и катоде.
235. Какой из процессов:
1) Fe 3+ + 1 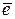 = Fe 2+;
= Fe 2+;
2) 2Н + + 2 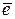 = Н2;
= Н2;
3) О2 + Н2О + 4 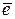 = 4(ОН) – ;
= 4(ОН) – ;
4) Fe 2+ + 2 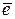 = Fe;
= Fe;
протекает на катодных участках при коррозии железных изделий в атмосферных условиях?
236. Стальной сосуд (основа железо) покрытый серебром имеет глубокие царапины. Напишите электронные уравнения процессов на аноде и катоде при коррозии сосуда в растворе соляной кислоты. Какой металл растворяется при коррозии? Какое это покрытие анодное или катодное?
237. Какие из частиц: Al3+; O2; H+; Cu будут принимать электроны при коррозии алюминиевых деталей с медными включениями в кислой среде? Составьте схему коррозионного гальванического элемента и напишите электронные процессы на аноде и катоде.
238. Корпус водяного насоса из сплава марки АЛ 19 (основа – алюминий), содержащего титан, цинк и марганец, эксплуатируется во влажной атмосфере. Какая составляющая сплава будет корродировать в первую очередь? Напишите электронные уравнения электродных процессов.
239. На стальное изделие (основа – железо) нанесено многослойное покрытие (Ni, Cu, Ag). Целостность покрытия нарушена. Какой из металлов будет корродировать в первую очередь?
240. В контакте с какими из ниже приведенных металлов никель будет корродировать: Zn, Fe, Cu, Ag?
ЭЛЕКТРОЛИЗ
Для решения задач, посвященных электролизу, необходимо иметь ясное представление об окислительно-восстановительных реакциях, электродах и электродных потенциалах, об электродных процессах окисления и восстановления, поляризационных явлениях на электродах, уметь рассчитывать величину электродных потенциалов по условиям электрохимического процесса с учетом поправок на электрохимическое перенапряжение [1…5, 10].
Электролиз – это окислительно-восстановительный процесс, протекающий на электродах при пропускании электрического тока через раствор или расплав электролита. При этом в раствор помещают как минимум два электрода. Один из них подсоединен к положительному полюсу источника тока и служит анодом, а другой – к отрицательному и служит катодом, на поверхности которого происходит восстановление.
Для того, чтобы ток непрерывно протекал в цепи на границе раздела металл – электролит, должны протекать электрохимические процессы: прием электронов на катоде и отдача электронов на аноде.
Пример 1. Какие процессы происходят на графитовых электродах при электролизе расплава СаС12? Рассчитайте величину UT (теоретическое напряжение разложения), необходимое для проведения электролиза. Электроды графитовые  при Т = 1050 K.
при Т = 1050 K.
Решение. Большое влияние на протекание процессов электролиза оказывает природа электродов и, прежде всего, анодов. Различают нерастворимые и растворимые аноды. Рассмотрение электрохимических процессов электролиза следует начинать с процессов окисления на аноде, т.к. возможно его растворение (окисление) и переход ионов в катодное пространство и восстановление их на катоде.
Нерастворимые (инертные) аноды изготавливают из угля, графита, Pt, Аu. При электролизе нерастворимые электроды не посылают электронов во внешнюю цепь, электроны посылаются в результате окисления анионов или молекул воды при электролизе водных растворов электролитов.
При рассмотрении процессов электролиза введем условные обозначения: вертикальной чертой разделим анодное и катодное пространства, электроды обозначим стрелками с указанием рядом материала, из которого они изготовлены. Возможные электродные процессы, которые мы сравниваем, подчеркнем горизонтальной чертой, а процесс, который преимущественно имеет место на аноде и катоде, заключим в рамку.
Расплавы щелочей и солей хорошо диссоциируют на ионы при высоких температурах. Схема электролиза:
CaCl2 = Ca 2+ + 2Cl –
А(+) 



 (–) К
(–) К
|

Так как электролиз – несамопроизвольный процесс, то ΔGT > 0. ΔGT этого процесса определяется по формуле
ΔGT = n∙F∙UT . (1)
где UT – теоретическое напряжение (напряжение разложения), необходимое для проведения процесса электролиза
 (2)
(2)
где n – число электронов, участвующих в процессе окисления.
Используя формулу (1), находим UТ (n = 2)
 В.
В.
Пример 2. Какие возможные процессы могут иметь место на платиновых (инертных) электродах при прохождении электрического тока через дистиллированную воду?
Решение. Вода является слабым электролитом, поэтому в окислительно-восстановительных процессах на электродах участвуют в основном молекулы воды по схеме:
станд. усл.; Н2О; рН = 7




|

|
В результате электролиза воды среда около катода становится щелочной (рН > 7), а около анода – кислой (рН < 7). Процесс электролиза выразится уравнением:
2Н2О = Н2 + О2.
Пример 3. Составьте схему и напишите уравнения электродных процессов, протекающих на гладких платиновых электродах (с учетом перенапряжения) при электролизе водного раствора хлорида калия в стандартных условиях, при активности ионов 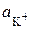 = 1 моль/л, среда кислая (рН < 7) за счет добавления кислоты с целью уменьшения сопротивления раствора, температура 298 K, плотность тока i = 10 A/м2.
= 1 моль/л, среда кислая (рН < 7) за счет добавления кислоты с целью уменьшения сопротивления раствора, температура 298 K, плотность тока i = 10 A/м2.
Решение. При электролизе водных растворов электролитов происходит «конкуренция» между растворенным веществом и растворителем – водой за участие в электрохимическом процессе на электродах. Поэтому состав продуктов окисления на аноде и восстановления на катоде зависит от природы электролита и других факторов. О том, какие частицы (ионы вещества или молекулы воды) будутв первую очередь разряжаться на электродах, можно судить по величине их электродных потенциалов. Из нескольких возможных процессов будет протекать тот, осуществление которого сопряжено с минимальной затратой энергии. В соответствии с этим действует правило: на аноде в первую очередь будут окисляться восстановленные формы систем с наименьшей алгебраической величиной электродного потенциала φ (наиболее активный восстановитель), а на катоде восстанавливаться окисленные формы электрохимических систем, имеющих наибольшую алгебраическую величину электродного потенциала, т.е. наиболее активный окислитель.
Перенапряжение кислорода  при его образовании на аноде заключается в смещении его потенциала в сторону положительных значений от равновесного потенциала кислородного электрода при соответствующем рН (табл. 10 приложения). Водород на катоде выделяется при потенциале более отрицательном, чем равновесный потенциал, отвечающий рН данного раствора. Перенапряжние водорода
при его образовании на аноде заключается в смещении его потенциала в сторону положительных значений от равновесного потенциала кислородного электрода при соответствующем рН (табл. 10 приложения). Водород на катоде выделяется при потенциале более отрицательном, чем равновесный потенциал, отвечающий рН данного раствора. Перенапряжние водорода  очень сильно зависит от природы катода, состояния его поверхности и плотности тока (табл. 11 приложения).
очень сильно зависит от природы катода, состояния его поверхности и плотности тока (табл. 11 приложения).
Электродный потенциал окисления или восстановления молекул воды, в случае электролиза водных растворов электролитов, с учетом перенапряжения выделения кислорода и водорода обозначим через φi.
При рассмотрении процессов на аноде и катоде следует использовать справочные данные (табл. 10, 11, 12 приложения).
Прохождение электрического тока через электрохимическую ванну создает некоторую разность потенциалов между электродами, направленную против внешней ЭДС:
UT = – ε = – (φK – φA) = φA – φK.
Возникновение обратной ЭДС при электролизе составляет сущность поляризации при электролизе. Причина её – поляризациякаждого электрода, которая заключается в сдвиге потенциала электрода от исходного равновесного значения, отвечающего определенной плотности тока.
Соль хлорид калия в водном растворе диссоциирует на ионы, которые переходят соответственно в анодное и катодное пространства.
Схема процесса электролиза водного раствора хлорида калия:
KС1 = K+ + Сl– ; Н2О; станд. усл.; рН<7

|

Пример 4. Составьте схему и напишите уравнения электродных процессов, протекающих на железных электродах (c учетом перенапряжения) при электролизе водного раствора сульфата алюминия в атмосфере воздуха, при активности ионов аА13+ =1 моль/л (среда нейтральная рН = 7), температуре 298 K плотности тока i = 10 А/м2.
Решение. Если водный раствор электролита содержит анионы кислородных кислот (SО42–; NO3–; СО32–; РО43–; СIO4–; МnO4–; Сr2О72– и др.), то на аноде окисляются не эти ионы, а молекулы воды в случае использования инертных электродов.
Схема процесса электролиза:
A12(SO4)3 = 2 А13+ + SО42– ; Н2О
Атмосф. возд. ; рН<7


|


В данном примере происходит окисление железного анода и ионы Fe2+ «переходят» в катодное пространство и восстанавливаются на катоде.
Пример 5. Какие вещества и в каком количестве будут выделяться на графитовых (инертных) электродах и образовываться в растворе при электролизе 1 М водного раствора MgCl2 (условия стандартные и рН = 7), если пропускать ток силой I = 10 А в течение τ = 6часов, aMg2+ = 1 моль/л?
Решение. Составим схему электролиза:
MgCl2 = Mg 2+ + 2Cl – ; Н2О
|
|





На аноде выделяется хлор, а на катоде – водород, а в растворе образуется гидроксид магния Mg(OH)2.
Количество образовавшихся веществ можно рассчитать по данным задачи, используя законы электролиза, открытые М. Фарадеем. Смысл этих законов следующий:
